
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的
,在不同的温度下该反应的
平衡常数如表所示
t ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述正确的是( )
A. 该反应的化学方程式是: H2(g)+CO2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
B. 上述反应的正反应是吸热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态
D. 某温度下,如果平衡常数符合下列关系式: ![]() =
=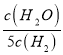 ,则此时温度700℃
,则此时温度700℃
【答案】C
【解析】A、根据化学平衡常数的表达式,此反应是CO(g)+H2O(g)![]() CO2(g)+H2(g),故A错误;B、化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,化学平衡常数减小,即上述反应的正反应是放热反应,故B错误;C、CO(g)+H2O(g)
CO2(g)+H2(g),故A错误;B、化学平衡常数只受温度的影响,根据表格数据,随着温度的升高,化学平衡常数减小,即上述反应的正反应是放热反应,故B错误;C、CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始:1 1 0 0
变化:0.5 0.5 0.5 0.5
平衡:0.5 0.5 0.5 0.5 此时的浓度商为1,而830℃时的化学平衡常数为1,故当CO2物质的量为0.5mol时,说明反应达到平衡,故C正确;D、根据关系式,c(CO2)×c(H2)/[c(CO)×c(H2O)]=3/5=0.6,此时的温度应为1000℃,故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
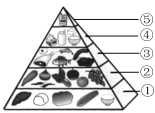
【题目】(1)保持营养平衡,是保证身心健康、提高生活质量的有效手段。
①“中国居民平衡膳食宝塔”(见下图),位于第“⑤”层且每天不超过25g的能量物质是________(填字母)。
a.谷类 b.油脂 c.无机盐
②我国居民在平时的饮食中应多吃碱性食物。下列食物属于碱性食物的是________(填字母)。
a.鱿鱼干 b.菠菜 c.苹果
③绿色植物通过下图储存能量,用化学方程式表示其光合作用的过程:____________________。

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①我国高速列车制造技术具有世界领先水平。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是________(填字母)。
a.铝合金 b.铁合金 c.碳纤维 d.硅纤维
②青铜在我国有悠久的历史,青铜的主要组成元素是铜和________(填元素符号)。青铜器表面容易生成一层薄薄的铜绿[主要成分是Cu2(OH)2CO3],请写出铜在潮湿的空气中发生电化学腐蚀时的正极反应式:_________________________________________。
③新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于________(填“合成纤维”“合成橡胶”或“塑料”)材料。特氟龙(聚四氟乙烯)可作为不粘锅涂层,写出该聚合物的结构简式:_____________________________。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①煤炭直接燃烧引起多种环境问题。治理被酸雨侵蚀过的酸性土壤,可以加入适量的________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.CaCO3
②处理含CO、SO2烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质硫,写出发生反应的化学方程式:_____________________________。
③据世界卫生组织报道,全世界75%左右的疾病与水体污染有关。污水处理方法很多,例如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中通入Cl2,可将CN-氧化为无毒的N2和CO2,使水质得到净化。写出该反应的离子方程式:_____________________________。
④消毒是饮用水处理中最重要的环节之一。近年来发展利用ClO2、O3消毒剂替代液氯,主要是人们发现液氯消毒会使水中的多种有机物发生变化,生成有害的物质如___________(填分子式)而可能致癌和致畸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,有以下三种:
部分氧化: CH4(g)+1/2O2(g) ![]() CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
CO(g)+2H2(g) ΔH1= —35.9kJ·mol-1 ①
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+3H2(g) ΔH2=+205.9kJ·mol-1 ②
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
CO2(g)+H2(g) ΔH3= —41.2kJ·mol-1 ③
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH4 ④
2CO(g)+2H2(g) ΔH4 ④
则反应②自发进行的条件是________________,ΔH4 =_____________kJ·mol-1。
(2)起始向密闭容器中充入一定量的CH4(g)和O2(g),发生反应①。CH4(g)的平衡转化率与温度(T)和压强(P)的关系如图所示。
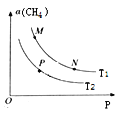
①N、P两点的平衡常数:K(N)_______K(P)(填“>”“<”或“=”),理由是_____________。
②M、N两点的H2的物质的量浓度c(M)____c(N)(填“>”“<”或“=”)。
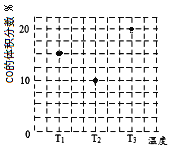
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) ![]() CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
CH3OH(g)。在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是_________(填“T1”或“T2” 或“T3”);该温度下的化学平衡常数为___________(用a、V表示)。
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等。则b极的电极反应式为_________。
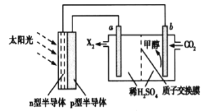
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
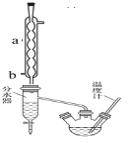
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:
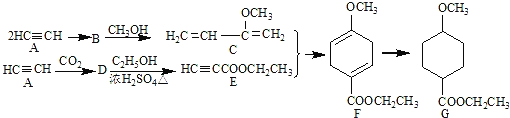
(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1mol G完全燃烧生成8mol H2O
d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中,加入500 mL 1 mol/L的盐酸,恰好使混合物完全溶解,放出672 mL(标准状况)气体。向所得溶液中加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能得到铁( )
A. 28 g B. 14 g
C. 12.32 g D. 条件不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是
出发合成BHT的方法有如下两种。下列说法不正确的是

A. 推测BHT在水中的溶解度小于苯酚
B. BHT与![]() 都能使酸性KMnO4褪色
都能使酸性KMnO4褪色
C. 方法一和方法二的反应类型都是加成反应
D. BHT与![]() 具有完全相同的官能团化合物
具有完全相同的官能团化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com