
| A、NH4+ |
| B、NO2 |
| C、NO |
| D、N2O3 |


科目:高中化学 来源: 题型:
| A、单质的颜色随核电荷数的增加逐渐变深 |
| B、随核电荷数的增加单质的氧化性逐渐增强 |
| C、随核电荷数的增加气态氢化物的稳定性逐渐减弱 |
| D、单质的熔沸点随核电荷数的增加逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、K+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-? |
| C、pH=12的溶液:K+、Mg2+、Cl-、Br- |
| D、碳酸氢钠溶液:K+、SO32-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性最强:B2 |
| B、还原性最强:X- |
| C、X2与B-一定不能发生反应 |
| D、X2与A-一定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积变大、呈酸性 |
| B、水的离子积不变、呈中性 |
| C、水的离子积变小、呈碱性 |
| D、水的离子积变大、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池使用的材料主要是硅 |
| B、实验室可以用NaOH溶液处理SO2和NO2废气 |
| C、氯气具有很强的氧化性,在化学反应中只能作氧化剂 |
| D、用盐酸可以清洗长期存放过FeCl3溶液的试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
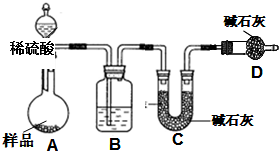
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com