
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
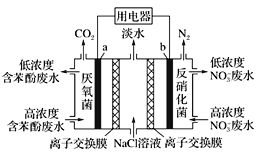
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
【答案】A
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则装置右边b电极为正极,电极反应为2NO3-+10e-+12H+=N2↑+6H2O,装置左边a极苯酚失电子发生氧化反应生成二氧化碳,电极反应为C6H5OH-28e-+11H2O=6CO2↑+28H+,结合原电池的工作原理作答。
根据上述分析可知,
A. a极为原电池的负极,发生的电极反应为:C6H5OH-28e-+11H2O=6CO2↑+28H+,A项正确;
B. b极为正极,发生还原反应,B项错误;
C. 中间室的Na+向原电池的正极(b极)移动,即向右室移动,C项错误;
D. 右室中的电极反应为2NO3-+10e-+12H+=N2↑+6H2O,则生成0.1 mol N2时,用电器流过1 mol电子,D项错误;
答案选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. ![]() =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
=0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。

(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下密闭容器中发生反应:NO(g) + CO(g) ![]() 1/2N2(g) + CO2(g) △H = —373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g) + CO2(g) △H = —373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 升高温度 B. 充入NO C. 增大压强 D. 加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 0.1 mol NaHSO4固体中含有的离子总数为0.3NA
B. 1L 1 mo1·L-1的(NH4)2CO3溶液中所含NH4+的数目为2NA
C. 标况下,22.4L Cl2通入水中,转移的电子数为NA
D. 20g D2O含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1 mo1·L-1的NH4HCO3溶液中逐滴加入NaOH,溶液中部分含氮、含碳微粒的分布情况如下图所示。下列说法不正确的是
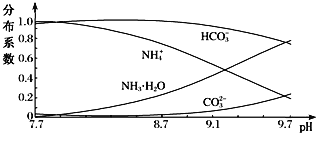
A. 开始阶段,HCO3- 增加的原因可能是:HCO3-的水解平衡逆向移动
B. pH在8.7~9.7之间,HCO3-和NH4+同时与OH-反应
C. 通过分析可知常温下:Kb(NH3·H2O)<Ka1(H2CO3)
D. pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
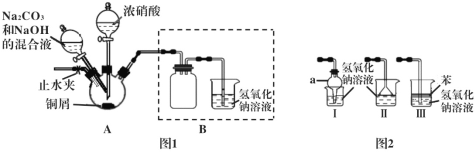
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,向某V L的密闭容器中充入2molH2(g)和2mol I2(g)发生反应: H2(g)+I2(g)![]() 2HI(g)
2HI(g)![]() =-26.5kJ/mol,测得各物质的物质的量浓度与时间变化的关系如图所示。
=-26.5kJ/mol,测得各物质的物质的量浓度与时间变化的关系如图所示。

请回答下列问题:
(1)V=__________.
(2)该反应达到最大限度了的时间是____________,该时间内平均反应速率v(HI)=________________。
(3)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com