
| A. | ②⑥ | B. | ①②④⑥ | C. | ③⑤⑥ | D. | ①②⑤⑥ |
分析 ①在标准状况下三氧化硫为固体;
②S2和S8均由硫原子构成;
③NO和O2反应后生成的NO2中存在平衡:2NO2?N2O4;
④铝离子在溶液中会水解;
⑤求出标准状况下,22.4LCl2的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
⑥铁离子为弱碱阳离子,在溶液中会水解.
解答 解:①在标准状况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故错误;
②S2和S8均由硫原子构成,故6.4g混合物中含有的额硫原子的物质的量为0.2mol,故含0.2NA个,故正确;
③NO和O2反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数变小,故生成的气体分子个数小于1.5NA个,故错误;
④铝离子在溶液中会水解,故溶液中的铝离子的个数小于NA个,故错误;
⑤标准状况下,22.4LCl2的物质的量为1mol,而氯气和碱的反应为歧化反应,故1mol氯气转移NA个电子,故正确;
⑥铁离子为弱碱阳离子,在溶液中会水解,故溶液中的Fe3+和SO42-离子数的总和小于0.5NA,故错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{118}^{175}$X | B. | ${\;}_{175}^{118}$X | C. | ${\;}_{118}^{293}$X | D. | ${\;}_{293}^{118}$X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
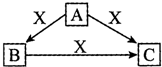 A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见的物质,一定条件下,它们有如下转化关系(部分产物已略去),下列说法错误的是( )| A. | 若X为Cl2,则C可能为FeCl3 | |
| B. | 若X为KOH溶液,则A可能为AlCl3溶液 | |
| C. | 若X为Fe,则A可能为HNO3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{10}$ | B. | $\frac{b}{2a+2b}$ | C. | $\frac{3}{16}$ | D. | $\frac{5}{16}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数的周期性变化 | |
| B. | 原子半径呈现从大到小的周期性变化 | |
| C. | 元素化合价呈现周期性的变化 | |
| D. | 元素的金属性和非金属性呈现周期性的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离汽油和四氯化碳 | 分液 | 四氯化碳和汽油的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去乙酸中的乙醚 | 蒸馏 | 乙酸与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com