
| A. | 标准状况下,22.4 LHF中分子总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| D. | .将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
分析 A.标况下HF为液态,22.4LHF不是1mol;
B.白磷(分子式为P4)中含有6个P-P共价键,31g白磷中含有0.25mol白磷分子,含有1.5mol共价键;
C.甲基(-14CH3)中含有9个电子,17g该甲基的物质的量为1mol,含有9mol电子;
D.氯水中存在物料守恒,氯元素总量等于溶液中氯元素各种存在形式总和.
解答 解:A.标况下HF为液态,22.4LHF不是1mol,故A错误;
B.白磷是正四面体型结构,分子中含有6个P-P共价键,31g白磷(分子式为P4)的物质的量是0.25mol,0.25mol白磷分子中含有1.5mol共价键,分子中含有P-P共价键1.5NA,故B正确;
C.甲基(-14CH3)中含有9个电子,17g该甲基的物质的量为1mol,含有9mol电子,所含的电子数为9NA,故C正确;
D.将1molCl2通入到水中,共含2mol氯原子,则N(HClO)+N(Cl-)+N(ClO-)=2NA,故D正确;
故选A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数和物质的量的计算,注意取代基和白磷的结构理解,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H 2(g)、I 2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 | |
| B. | 久置的氯水变成了稀盐酸 | |
| C. | 在FeCl 3溶液中加入铁粉防止氧化变质 | |
| D. | 加入催化剂有利于SO 2与O 2反应制SO 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为2.12g. |
| (2)称量Na2CO3固体 | 称量过程中应用到的主要仪器是分析天平或电子天平. |
| (3)将Na2CO3加入100mL烧杯中,加入适量蒸馏水 | 为了加快溶解速率,常采取的措施是用玻璃棒搅拌. |
| (4)将烧杯中的溶液转移至仪器A(已检查不漏水)中 | ①在转移Na2CO3溶液前应将溶液冷却至室温; ②仪器A是100mL容量瓶; ③为防止溶液溅出,应采取的措施是用玻璃棒引流. |
| (5)向仪器A中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是加蒸馏水至容量瓶中的液面接近刻度线1-2cm处,改用胶头滴管滴加至溶液的凹液面正好与刻度线相切. |
| (6)摇匀、装瓶,操作B,最后清洁、整理 | 操作B是贴标签. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
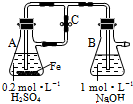
| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除①④外 | B. | 除②外 | C. | 除⑤外 | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铜与浓硝酸或稀硝酸反应 | |
| B. | 钠在常温或加热条件与氧气反应 | |
| C. | 铁在少量氯气或过量的氯气中点燃 | |
| D. | 氯化铝溶液与少量氢氧化钠溶液或过量氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
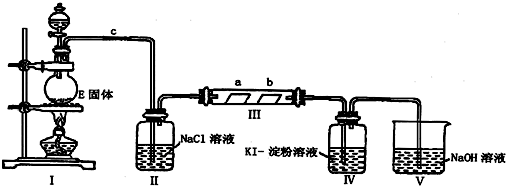
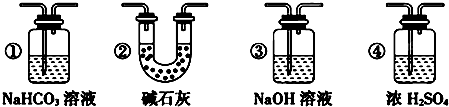
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com