
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl | B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | Cl2+H2O═HCl+HClO |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的N4、N5分子其原子数之比为5:4 | |
| B. | N5、N4与N2互为同素异形体 | |
| C. | N4、N5均属于新型的化合物 | |
| D. | N5的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铝粉投入溶液中会产生氢气:Mg2+、NO3-、K+、SO42- | |
| B. | 滴加石蕊试液会使溶液变蓝:Na+、Al3+、CO32-、NO3- | |
| C. | 将锌粒投入溶液中会产生氢气:Ca2+、Cl-、Mg2+、NH4+ | |
| D. | 溶液能使淀粉碘化钾试纸变蓝NH4+、CO32-、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
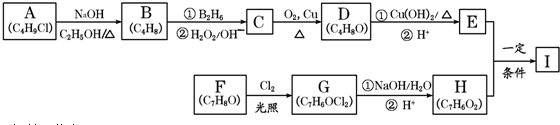
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com