
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH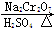 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
科目:高中化学 来源: 题型:实验题
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)乙同学认为有Cu(OH)2生成的理论依据是 (用离子方程式表示)。
(3)两同学利用下图所示装置进行测定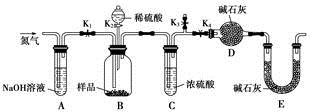
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。
若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
(4)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: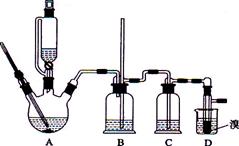
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤 b.加热蒸发 c.冷却结晶 d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+ H2SiO3↓+ CO2↑+
NH4F+ H2SiO3↓+ CO2↑+
(3)流程①中NH4HCO3必须过量,其原因是 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
肉桂酸用途广泛,常被用作食品保鲜剂、食品添加剂、有机合成中间体等。其一种合成原理如下:
【实验步骤】
①向A中依次加入沸石、一定比例的苯甲醛、乙酸酐及少许碳酸钾。
②控制温度1500C~1700C,使其充分反应。
③向冷却后的三口瓶内加入饱和碳酸钠溶液,调节pH至9~10。
④如装置B所示,用水蒸气蒸馏,除去未反应的苯甲醛。
⑤加入活性炭,充分振荡并煮沸脱色。
⑥……
(1)装置A中冷凝管由 端(填“a”或“b”)通入冷凝水。
(2)步骤③中加入饱和碳酸钠溶液将肉桂酸、醋酸转化为肉桂酸钠和醋酸钠的原因: 。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为 ,玻璃管的作用为 。
(4)当观察到冷凝管中 ,说明水蒸气蒸馏结束。
(5)步骤⑥通过以下操作分离、提纯得较纯净的肉桂酸(难溶于水),其正确的操作顺序是 (填字母)。
a.重结晶 b.冷却、抽滤,水洗晶体
c.加入浓盐酸调节pH=3 d.静置,趁热过滤得肉桂酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
| 相对分子质量 | 32 | 122 | 136 |
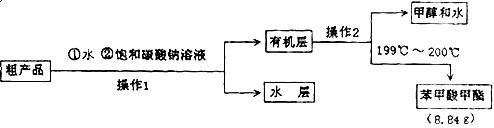
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: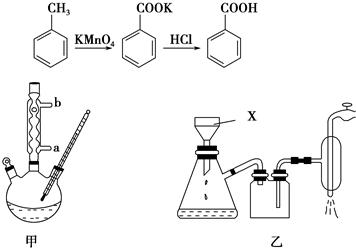
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
由呋喃甲酸脱羧得到呋喃与丙酮在酸性条件下缩合,可得到八甲基四氧杂夸特烯。有关实验原理及流程如下; 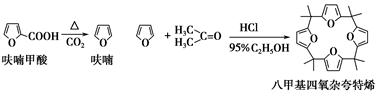
步骤1:呋喃的制备
在圆底烧瓶中放置4.5 g呋喃甲酸(100 ℃升华,呋喃甲酸在133 ℃熔融,230~232 ℃沸腾,并在此温度下脱羧),按图安装好仪器。先大火加热使呋喃甲酸快速熔化,然后调节加热强度,并保持微沸,当呋喃甲酸脱羧反应完毕,停止加热。得无色液体呋喃(沸点:31~32 ℃,易溶于水)。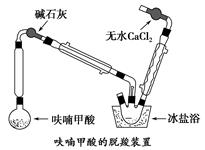
步骤2:大环化合物八甲基四氧杂夸特烯的合成
在25 mL锥形瓶中加入2.7 mL 95%乙醇和1.35 mL浓盐酸,混匀,在冰浴中冷至5 ℃以下,然后将3.3 mL丙酮和1.35 mL呋喃的混合液迅速倒入锥形瓶中,充分混匀,冰浴冷却,静置得一黄色蜡状固体。过滤,并用3 mL无水乙醇洗涤,用苯重结晶,得白色结晶八甲基四氧杂夸特烯。
(1)步骤1中用大火急速加热,其主要目的是____________________________。
(2)装置图中碱石灰的作用是__________________________________________;
无水氯化钙的作用是________________________________________________。
(3)脱羧装置中用冰盐浴的目的是_____________________________________。
(4)合成八甲基四氧杂夸特烯加入盐酸的目的是_________________________。
(5)确论产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。以铁屑为原料的制备流程如下: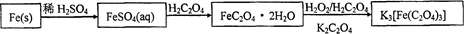
请回答下列问题:
(1)铁屑中常含硫元素,加稀硫酸时会产生有毒的H2S气体,可用氢氧化钠溶液吸收,下列吸收装置正确的是 。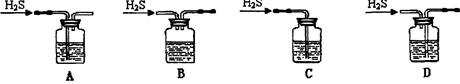
(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是 。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是 (按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)该晶体盐在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验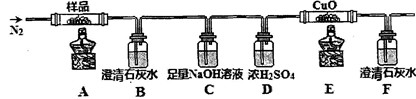
装置检查气密性后,先通一段时间N2,其目的为 。结束实验时先熄灭酒精灯再通入N2至常温,其目的为 。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则气体产物是 。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列三种实验方案对该样品进行物质含量测定。
【甲】a g样品 溶液
溶液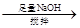
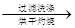 得固体b g
得固体b g
【乙】a g样品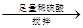
 量气测得气体体积Va mL
量气测得气体体积Va mL
【丙】a g样品 250 mL溶液
250 mL溶液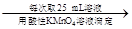 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com