
| A、金属钠保存在水中 |
| B、烧碱溶液保存在玻璃塞试剂瓶中 |
| C、金属钠保存在无水乙醇中 |
| D、浓硝酸可贮存在铝制容器中 |


科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B、通入SO2气体后的溶液:Na+、Ca2+、K+、Cl- |
| C、0.1 mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D、1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
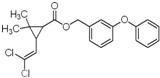
| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项实验器材(省略夹持装置)相应实验 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和苯除去NaBr溶液中少量NaI |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体碳酸钠配制0.5mol/L的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、酒精灯 | 硫酸铜溶液的浓缩结晶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸,沉淀全部溶解 |
| D、向盛有FeCl2溶液的试管中滴加NaOH溶液,最终生成红褐色的Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol |
| B、0.04mol |
| C、0.06mol |
| D、0.08mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它的单质常温时为气态.试用化学符号回答以下问题.
,它的单质常温时为气态.试用化学符号回答以下问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com