
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
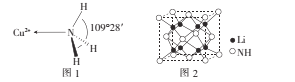
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
【答案】F>N>O 1s22s22p63s23p63d8或[Ar] 3d8 激发 平面三角形 sp3 9:1 分子晶体 分子数相同时,甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多(或甘氨酸中氨基的存在也会使分子间产生氢键) 形成配合离子后,配位键与NH3中N—H键之间的排斥力小于原孤对电子与NH3中N—H键之间的排斥力,故配合离子中NH3的N—H键间的键角变大; ![]()
【解析】
(1)与氧相邻且同周期的元素为N和F,由于N原子最外层电子为半充满状态,第一电离能较大,所以三者第一电离能由大到小的顺序为F>N>O;Ni元素为28号元素,失去最外层两个电子形成Ni2+,基态Ni2+的核外电子排布式为1s22s22p63s23p63d8或[Ar] 3d8;基态Ni2+的核外电子空间运动状态有1+1+3+1+3+5=14种,若该离子核外电子空间运动状态有15种,则该离子处于激发态;
(2)①NO3的中心原子价层电子对数为![]() =3,孤电子对数为0,所以空间构型为平面三角形;
=3,孤电子对数为0,所以空间构型为平面三角形;
②甘氨酸(NH2CH2COOH)中N原子形成两个N-H键和一个N-C键,达到饱和状态,价层电子对数为4,所以为sp3杂化;分子中碳氧双键中存在一个π键,其余共价键均为σ键,所以分子中σ键与π键的个数比为9:1;甘氨酸熔沸点较低属于分子晶体;分子数相同时,甘氨酸分子间形成的氢键数目比丙酸分子间形成的氢键数目多(或甘氨酸中氨基的存在也会使分子间产生氢键);
(3)形成配合离子后,配位键与NH3中N—H键之间的排斥力小于原孤对电子与NH3中N—H键之间的排斥力,故配合离子中NH3的N—H键间的键角变大;
(4)根据均摊法,该晶胞中Li原子个数为8,其分子式为Li2NH,则晶胞中NH原子团的个数为4,则晶胞的质量为m=![]() g,晶胞参数为d pm=d×10-10cm,所以晶胞的体积V=d3×10-30cm3,则密度
g,晶胞参数为d pm=d×10-10cm,所以晶胞的体积V=d3×10-30cm3,则密度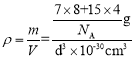 ,解得NA=
,解得NA=![]() 。
。


科目:高中化学 来源: 题型:
【题目】在某种光电池中,当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s)![]() Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )
Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )

A.光电池工作时,Ag极为电流流出极,发生氧化反应
B.制氢装置溶液中K+移向A极
C.光电池工作时,Ag电极发生的反应为2Cl--2e-=Cl2↑
D.制氢装置工作时,A极的电极反应式为CO(NH2)2+8OH-6e-=CO32-+6H2O+N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间硝基苯胺是一种重要的有机合成中间体,它是一种黄色针状晶体,微溶于冷水,在水中的溶解度随温度升高而增大,易溶于乙醇、乙醚、甲醇等。实验室制备间硝基苯胺的反应原理及装置如下(夹持及加热装置略去):
4 +6NaHS+H2O→4
+6NaHS+H2O→4 +3Na2S2O3
+3Na2S2O3

实验步骤:
①硫氢化钠溶液的制备。将0.05molNa2S9H2O溶于25mL水中,分批加入4.2gNaHCO3粉末,完全溶解后,慢慢加入30ml.甲醇,冰水浴冷却,立即析出一水合碳酸钠。静置,抽滤,滤饼用15mL甲醇分三次洗涤,合并滤液和洗涤液备用。
②间硝基苯胺的制备。在A中将0.03 mol间二硝基苯溶于40 mL热甲醇中,装上B,从B的顶端加入上述硫氢化钠溶液,水浴加热回流20min。冷却至室温后,改为蒸馏装置,蒸出大部分甲醇,将残液倾入150mL冷水中,立即析出间硝基苯胺粗品,抽滤,洗涤,重结晶,脱色后,得黄色的间硝基苯胺针状晶体2.4 g。回答下列问题:
(1)仪器B的名称是________, 使用时要从_____(填“ a”或“b”)口通入冷水;滴液漏斗的细支管c的作用是________。
(2)写出步骤①中总反应的离子方程式:____________。
(3)步骤①中合并洗涤液的目的是________。
(4)步骤②中制备装置改为蒸馏装置,需增加的仪器除了蒸馏头、温度计、尾接管之外,还有________、________。
(5)步骤②中蒸出大部分甲醇的目的是__________。
(6)步骤②中洗涤粗品使用的洗涤剂为_____;粗品脱色使用的脱色剂可以是______。
(7)本实验的产率为______[保留 2位有效数字;Mr(间硝基苯胺) = 138]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积固定的密闭容器中,发生反应H2(g)+I2(g)![]() 2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
A.断裂1 mol H-H键,同时生成2 mol H-I键B.容器内压强保持不变
C.容器内气体颜色保持不变D.容器内H2、I2和HI的物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
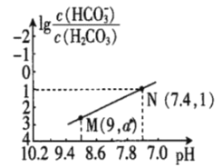
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、![]() 、K+、Mg2+、Fe3+、Al3+、Cl-、
、K+、Mg2+、Fe3+、Al3+、Cl-、![]() 、
、![]() 、
、![]() 中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
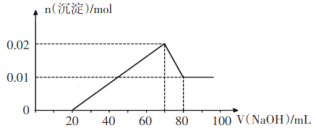
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、![]() 、
、![]()
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,碘在某液态有机物M和水之间的分配比D=85(分配比D=![]() ),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
A.锥形瓶中水层为无色,M层为紫色,
B.20mL中M层的I2浓度约为0.099mol/L
C.I2单质溶于有机物M时需要断裂化学键
D.40mL中M层的I2浓度大于20mL中M层的I2浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
B | 向酸性KMnO4 溶液中滴加乙醇 | 溶液褪色 | 乙醇具有还原性 |
C | 向溴水中加入苯,充分振荡、静 置 | 水层几乎无色 | 苯与溴发生了反应 |
D | 向FeCl3和BaCl2 的混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,白色沉淀为BaSO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com