
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
A.c(NH4+):③>②
B.pH:①>②>③
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)向溶解方向移动
Mg2+(aq)+2OH-(aq)向溶解方向移动
D.等体积①和③混合溶液中c(Cl-)>c(NH4+)>c(H+)>c(CH3COO-)>c(OH-)
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2016-2017学年山东省菏泽市高二上学期期中化学试卷(解析版) 题型:选择题
某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之 发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A.X2+2Y2 XY2 B.3X2+Y2
XY2 B.3X2+Y2 2X3Y
2X3Y
C.2X2+Y2 2X2Y D.X2+3Y2
2X2Y D.X2+3Y2 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上学期期中化学试卷(解析版) 题型:实验题
1、某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸注入洁净的锥形瓶中,并加入2~3滴酚酞; |
B.用标准溶液润洗滴定管2~3次; |
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________AF。
(2)上述B步骤操作的目的是_____________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的 (填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)____________(①=10mL,②=15mL,③<10mL,④>15mL)。
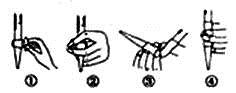
(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无 影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是__________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是____________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上学期期中化学试卷(解析版) 题型:选择题
下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | C | HNO2 |
电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A.HCN B.HF C.CH3COOH D.HNO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.体积相等pH=12的氨水和NaOH溶液中和盐酸的 能力相同
能力相同
B.室温下,向NH4HS O4溶液中加入NaOH溶液至中性,则c(SO42-)
O4溶液中加入NaOH溶液至中性,则c(SO42-) >c(Na+)>c(NH4+)
>c(Na+)>c(NH4+)
C.物质的量浓度之比为1:2的CH3COOH和CH3COONa的混合溶液中:
2[c(CH3COOH)+c(CH3COO-)]=3c(Na+)
D.向10ml 0.01mol/L AgNO3溶液中依次滴入2~3滴0.01mol /L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Ksp(AgI)<Ksp(AgCl)
/L NaCl溶液、0.01mol/L NaI溶液,所得沉淀由白色变成黄色,则可推知Ksp(AgI)<Ksp(AgCl)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:选择题
现有两瓶温度分别为15 ℃和45 ℃,pH均为1的硫酸溶液,下列有关说法不正确的是 ( )
A.两溶液中的c(OH-)相等 B.两溶液中的c(H+)相同
C.等体积两种溶液中和碱的能力相同 D.两溶液中的c(H2SO4)基本相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:选择题
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①向0.1 mol·L-1 CH3COOH溶液中加入少量冰醋酸,平衡向正反应方向移动,电离程度增大;
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+) +c(H+)=c(OH-)+c(CH3COO-)
+c(H+)=c(OH-)+c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同;
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积
A.①②④ B.②④ C.②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上期中化学卷(解析版) 题型:选择题
某温度下,在固定容积的密闭容器中,可逆反应A(气)+3B(气) 2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,B的体积分数减小
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高二上期中化学卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应为___________反应。(填“吸热”或“放热”)
(2)830℃,c(CO)=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, C(H2)=0.05mol/L,该反应__________(填“是”或“否”)达到的化学平衡状态。
(3)800℃时,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)=0.01 mol/L,c(H2O)=0.03 mol/L,c(CO2)=0.01 mol/L,c(H2)=0.05 mol/L,则反应开始时,H2O的消耗速率比生成速率___________(填“大”、“小”或“不能确定”)
(4)830℃时,在1L的固定容积的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为___________,H2的转化率为___________(用分数表示)。若再充入1mol H2则H2的转化率为___________(增大,减少,不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com