
【题目】下图是石蜡油在炽热碎瓷片的作用下产生某气体并检验其性质的相关实验,请完成下列问题:
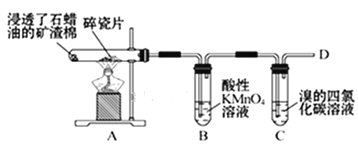
(1)A中产生的气体是___________(填名称),该物质的结构式__________________________;
(2)B中实验现象:_____________________,原因是:__________________________________;
(3)C中发生反应的化学方程式:_________________________________,反应类型:______________ ;
(4)在D处点燃时必须进行的操作_________________________________;
(5)下列说法正确的是(_______)
A.聚乙烯塑料可以用做食品袋、餐具和地膜
B.乙烯分子中所有原子不共面
C.高锰酸钾溶液浸泡过的硅藻土可以保鲜水果
D.乙烯是一种植物生产调节剂,可以延长果实和花朵的成熟期
【答案】 乙烯 ![]() 溶液紫红色褪去 乙烯将MnO4-还原为Mn2+ CH2=CH2 +Br2 →CH2BrCH2Br 加成反应 检验乙烯的纯度 AC
溶液紫红色褪去 乙烯将MnO4-还原为Mn2+ CH2=CH2 +Br2 →CH2BrCH2Br 加成反应 检验乙烯的纯度 AC
【解析】试题分析:本题考查石蜡油裂解制乙烯,乙烯的性质和用途。
(1)石蜡油在炽热碎瓷片的作用下产生乙烯,A中产生的气体是乙烯,乙烯的结构式为![]() 。
。
(2)乙烯中含碳碳双键,能被酸性KMnO4溶液氧化,B中实验现象是:溶液紫红色褪去。原因是:乙烯将紫红色的MnO4-还原为无色的Mn2+。
(3)乙烯中含碳碳双键,与溴的四氯化碳溶液发生加成反应,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应。
(4)直接点燃乙烯可能发生爆炸,所以在点燃乙烯之前必须的操作是:检验乙烯的纯度。
(5)A项,聚乙烯塑料耐化学腐蚀、耐寒,无毒,可以用做食品袋、餐具和地膜,正确;B项,乙烯分子碳原子采取sp2杂化,乙烯分子中2个碳原子和4个氢原子处于同一平面,错误;C项,乙烯是一种植物生长调节剂,植物在生命周期的许多阶段都会产生乙烯,用高锰酸钾溶液浸泡过的硅藻土吸收水果产生的乙烯可以保鲜水果,正确;D项,乙烯是一种植物生长调节剂,可加快果实和花朵的成熟,缩短成熟期,错误;答案选AC。


科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式 .
(2)C元素的第一电离能比氧元素的第一电离能(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是 .
(4)A、C、E三种元素可形成[E(CA3)4]2+ , 其中存在的化学键类型有(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl﹣取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为 , 若该晶体的密度为a gcm﹣3 , 则该晶胞的体积是cm3(写出表达式即可). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置不能完成相应实验的是( )

A. 用装置①测量生成氧气的化学反应速率
B. 用装置②比较NaHCO3和Na2CO3的热稳定性
C. 装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶
D. 装置④可实现制取CO2实验中的“即关即止,即开即用”的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水氯镁石(主要成分为MgCl26H2O)为原料生产碱式碳酸镁[Mgx(CO3)y(OH)zwH2O]的主要流程如图: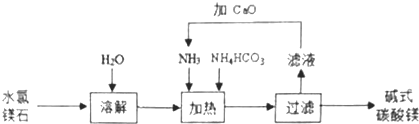
(1)上述流程中,滤液中溶质的主要成分(写化学式),向滤液中加入CaO的目的是 .
(2)上述流程中,检验“过滤”后碱式碳酸镁已洗涤干净的方法是 .
(3)已知高温煅烧碱式碳酸镁可得到MgO,取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L.通过计算确定碱式碳酸镁的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭可以转化为清洁能源和化工原料。
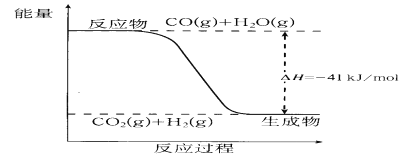
⑴用煤可以制得水煤气,其化学反应方程式为________________________________。
⑵已知一氧化碳与水蒸气反应过程的能量变化如图所示。则此反应为_________(填“放热”或“吸热”)反应,反应的热化学方程式为___________________________________。
⑶已知1mol C完全转化为水煤气时吸收热量131.5kJ,则1mol C与CO2反应生成CO吸收热量______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列物质所含分子数最多的是( )
A.0.8 mol二氧化碳
B.标准状况下2.24L氨气
C.3.6 g水
D.含NA个氢分子的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH 步骤中,溶液pH的调节范围是________。
(2)滤渣1和滤渣3 主要成分的化学式分别是________、________。
(3)写出氧化步骤中加入H2O2 发生反应的离子方程式________。
(4)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________g。(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com