
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验. 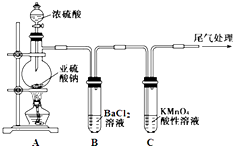
已知:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是 .
(2)实验过程中,C中的现象是 , 说明SO2具有性.
(3)实验过程中,观察到装置B中出现了明显的白色沉淀.为探究该白色沉淀的成分,该小组同学进行了如下实验: ![]()
根据实验事实判断该白色沉淀的成分是(填化学式),产生该白色沉淀的原因可能是(填字母编号).
a.BaSO3既不溶于水也不溶于酸 b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3 , 对此实验是否有影响并明理由 .
【答案】
(1)分液漏斗
(2)KMnO4溶液褪色;还原
(3)BaSO4;bd
(4)有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体
【解析】解:(1)该仪器名称是分液漏斗,所以答案是:分液漏斗; (2)二者反应生成锰离子和硫酸根离子而使高锰酸钾溶液褪色,通过该反应说明二氧化硫具有还原性,该反应说明二氧化硫具有还原性,所以答案是:KMnO4溶液褪色;还原;(3)硫酸钡不溶于酸和水,亚硫酸钡易溶于酸,该沉淀不溶于稀盐酸,说明沉淀是硫酸钡;
二氧化硫具有还原性,在水溶液里能被氧化剂氧化生成硫酸根离子,所以二氧化硫或氯化钡溶液中可能含有氧气将二氧化硫氧化为硫酸根离子,故选bd;
所以答案是:BaSO4;bd;(4)浓硫酸具有强氧化性,但不能氧化亚硫酸钠,浓硝酸具有强氧化性,能将亚硫酸钠氧化物硫酸钠而得不到二氧化硫,所以不能将浓硫酸换为浓硝酸,所以答案是:有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体.


科目:高中化学 来源: 题型:
【题目】如图装置,A,B中的电极为多孔的惰性电极;C,D为夹在湿的Na2SO4滤纸条中心的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1 , 闭合K2、K3通直流电,则:①标出电源的正、负极,a为极,b为极.
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 .
③写出电极反应式:
A中 .
B中 .
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3 , 闭合K1 , 则电流表的指针是否移动(填是或否) . 若电流表指针不移动说明理由,若指针移动也说明理由 . 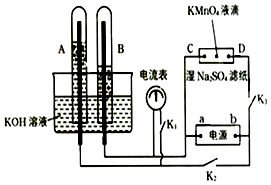
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 植物油氢化过程属于物理变化
B. 蛋白质是仅由碳、氢、氧元素组成的物质
C. 淀粉、纤维素和油脂都属于天然高分子化合物
D. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是( )
A.铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑
B.石灰石与稀盐酸反应制备二氧化碳:CO ![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
C.向氢氧化铜中滴加硫酸溶液:H++OH﹣=H2O
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO ![]() +Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓
+Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素号称“工业维生素”,科学家把稀土元素镧对作物的作用赋予“超级钙”的美称.已知镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3 , La(OH)3是不溶于水的弱碱,而LaCl3、La(NO3)3都可溶于水,下列说法中正确的是( )
A.La(NO3)3水溶液显酸性
B.LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3
C.La和盐酸反应的离子方程式为:La+2H+=La3++H2↑
D.镧有两种核素: ![]() 和放射性
和放射性 ![]() ,由此可知镧元素的相对原子质量为138.5
,由此可知镧元素的相对原子质量为138.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+浓度最大的是
A.0.8L0.4mol/L的NaOH溶液B.0.2L0.15mol/L的Na3PO4溶液
C.1L0.3mol/L的NaCl溶液D.4L0.5mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A、B、C、D为中学化学常见单质,B为黄绿色气体,C为无色气体,在一定条件下转化关系如图(部分生成物略去);其中F为淡黄色化合物,H为红褐色沉淀c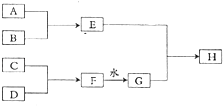
回答下列问题:
(1)C的化学式
(2)F→G反应的化学方程式
(3)向E溶液中通入一定量虽的SO2气体,溶液由黄色变为浅绿色.①浅绿色溶液中一定大量存在的离子有H+、Cl﹣和 .
②某同学认为反应后的溶液中可能存在H2SO3 , 应选择以下试剂(填写序号)加以检验.
A.稀硫酸 B.NaOH溶液C.KSCN溶液D.品红溶液
(4)某温度下,将B(设B的化学式为X2)通入NaOH溶液中,反应得到NaX、NaXO、NaXO3的混合液,经测定XO﹣与XO ![]() 的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
(5)少量D在实验室中的保存方法是
(6)B的氢化物的水溶液不与Cu反应.若再加入H2O2后,则可使铜顺利溶解.该反应的化学方程式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com