
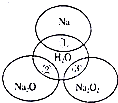
 ��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ�IJ��ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������| A�� | ��Ӧ������ܲ���0.05molO2 | |
| B�� | ��Ӧ�ٵ����ӷ���ʽΪNa+2H2O=Na++2OH-+H2�� | |
| C�� | �١��ڡ��۶�����������ԭ��Ӧ | |
| D�� | �١��ڡ��۳�ַ�Ӧ��������Һ�����ʵ������������٣��ڣ��� |
���� A�����ݹ������ƺ�ˮ��Ӧ�ķ���ʽ�����������������ʵ�����
B�����ӷ���ʽҪ��ѭ��ԭ���غ�͵���غ�ȡ����ɣ�
C����������ˮ��Ӧ��Ԫ�ػ��ϼ۵ı仯��
D�����ݹ�������ʵ���������Һ�����ʵ���������Һ����������������������ʽ�ж�����������Դ�С��
��� �⣺A����Ӧ�ۣ�2Na2O2+2H2O=4NaOH+O2����
2mol 1mol
0.1mol 0.05mol
���ݷ���ʽ֪��������0.05molO2����A��ȷ��
B��Na+2H2O�TNa++2OH-+H2���е�ɲ��غ㣬��Ӧ����ȷ�����ӷ���ʽΪ��2Na+2H2O=2Na++2OH-+H2������B����
C����������ˮ��Ӧ�������������Ƿ�������ԭ��Ӧ����C����
D���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+$\frac{1}{2}$H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�
������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������ơ��ֱ�����ˮ������Һ�����������ֱ�Ϊ��$\frac{4g}{100g+2.2g}$��$\frac{8g}{100g+6.2g}$��$\frac{8g}{100g+6.2g}$�����Ԣ١��ڡ��۳�ַ�Ӧ��������Һ�����������Ӵ�С���٣���=�ۣ���D����
��ѡA��
���� ���⿼�����Ƽ��仯��������ʣ���������ˮ��Ӧ�Ƿ�������ԭ��Ӧ��Ϊ�״��㣬ע��֪ʶ�Ĺ��ɺ������Լ����Ӧ���ǹؼ����ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �μӼ�����Һ�Ժ�ɫ����Һ Fe3+��NH4+��Cl-��SCN- | |
| B�� | ˮ���������c��H+��=10-13mol/L����Һ K+��HCO3-��Br-��Ba2+ | |
| C�� | pHֵΪ1����Һ Cu2+��Na+��Mg2+��NO3- | |
| D�� | ��������ΪNa2SO4����Һ K+��HCO3-��NO3-��H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ���������������ڰ�����ϵ | B�� | ���������������������ڰ�����ϵ | ||
| C�� | �����뻯�������ڽ����ϵ | D�� | ��ɢϵ�뽺�����ڲ��й�ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4��Ħ��������98 | |
| B�� | 0.5mol Na2SO4�к�Na+��ĿΪ6.02��1023�� | |
| C�� | ��״���£�1molH2O���ԼΪ22.4L | |
| D�� | 1molO2������Ϊ32g/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3-CH=CH-COOH�� | B�� |  ��CH3CH2OH ��CH3CH2OH | ||
| C�� | 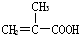 ��HOCH2CH2OH ��HOCH2CH2OH | D�� | CH3-CH=CH-COOH��CH3CH2OH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ϊ�д̼�����ζ����˲������������ | |
| B�� | Ũ����ϡ������Ũ��������������ˮ�����ò��������ϵĽ��� | |
| C�� | Ԫ�����ڱ��У������������ڸ�Ԫ��ԭ�ӵ����������� | |
| D�� | ��ˮ������ͨ��CO2��Na2SiO3+CO2+H2O=Na2CO3+H2SiO3�� ��֤��̼�������ǿ�ڹ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5����10-8+10-10��mol•L-1 | B�� | ��10-8+10-10��mol•L-1 | ||
| C�� | ��1��10-5-5��10-14��mol•L-1 | D�� | 2��10-10mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Fe2O3���� | B�� | ��������������䣬����H2������ | ||
| C�� | ����N2������������ѹǿ���� | D�� | ����N2������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com