
分析 (1)分子式为C3H6的有机物可能为丙烯,也可能为环丙烷△;
(2)C4H10为丁烷,丁烷存在正丁烷和异丁烷两种结构;
(3)分子式为CH2O的有机物为甲醛,不存在同分异构体;
(4)分子式为C4H10O的有机物,可能为醇类物质,也可能为醚类.
解答 解:(1)分子式为C3H6的有机物可能为丙烯:CH2=CH-CH3,也可能为环丙烷:△,
答:有同分异构体,分别为CH2=CH-CH3、△;
(2)C4H10为丁烷,丁烷存在正丁烷和异丁烷两种结构,结构简式分别为:CH3CH2CH2CH3、(CH3)2CHCH3,
答:有同分异构体,其结构简式分别为CH3CH2CH2CH3、(CH3)2CHCH3;
(3)分子式为CH2O的有机物为甲醛,不存在同分异构体,甲醛的结构简式为HCHO,
答:无同分异构体;
(4)分子式为C4H10O,是醇类有机化合物的同分异构体有4种: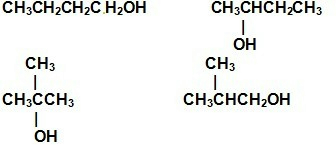 ,属于醚类的有:CH3-O-CH2CH2CH3、CH3CH2-O-CH2CH3、CH3-O-CH(CH3)CH3,
,属于醚类的有:CH3-O-CH2CH2CH3、CH3CH2-O-CH2CH3、CH3-O-CH(CH3)CH3,
答:有同分异构体,分别为 、CH3-O-CH2CH2CH3、CH3CH2-O-CH2CH3、CH3-O-CH(CH3)CH3.
、CH3-O-CH2CH2CH3、CH3CH2-O-CH2CH3、CH3-O-CH(CH3)CH3.
点评 本题考查了同分异构体的书写,题目难度中等,明确同分异构体的概念及书写原则为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol/(L•s) | B. | 3.6 mol/(L•s) | C. | 1.2 mol/(L•s) | D. | 0.04mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2?N2O4-①N2O4?2NO2-②,反应①的化学平衡常数是反应②的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,将100.0mL 0.05mol/LBa(OH)2溶液与100.0mL 0.05mol/L H2SO4溶液混合,在298K、101kPa条件下放出热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化:HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com