
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展的需要 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
分析 A.电池中的重金属离子污染土壤和水源;
B.从农产品的农药残留和对土壤的长期影响考虑;
C.煤、石油、天然气的大力开发,严重污染了环境;
D.太阳能、风能和氢能是洁净能源.
解答 解:A.电池中的重金属离子污染土壤和水源,不能掩埋,应回收处理,不符合题意,故A错误;
B.使用农药和化肥固然有利于增加农作物的产量,但会在农产品中造成农药残留,会使土地里的盐碱越来越多,土壤越来越硬,影响农作物的生长,不符合题意,故B错误;
C.大力开采煤、石油和天然气,虽然满足经济发展的需要,但严重污染了环境,不符合题意,故C错误;
D.开发太阳能、风能和氢能等洁净能源可减少化石燃料的使用,减少污染物的排放,符合题意,故D正确;
故选D.
点评 本题主要考查了化学知识在生活实际的应用,熟悉能源问题、废旧电池回收等即可解答,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:实验题
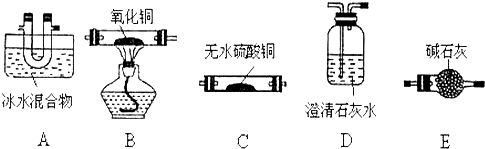
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
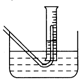 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 BaCl2 NaOH | B. | CaC12 HCl KNO3 | ||
| C. | KOH HCl (NH4)2SO4 | D. | Fe2O3 KCl NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是硫及某些含硫化合物在空气中燃烧的产物 | |
| B. | SO2有漂白作用,也有杀菌作用 | |
| C. | SO2溶于水后生成H2SO4 | |
| D. | SO2是一种大气污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | Na+、NH4+、CO32-、NO3- | ||
| C. | Ag+、K+、Cl-、SO42- | D. | K+、AlO2-、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com