
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列有关含氮物质的问题:
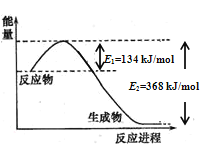
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______________________________________________;
恒温恒容条件下,不能说明该反应已达到平衡状态的是________![]() 填序号
填序号![]() 。
。
A.容器内混合气体颜色不再变化 ![]() 容器内的压强保持不变
容器内的压强保持不变
C.v逆(NO2)=v正(NO) ![]() 容器内混合气体密度保持不变
容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)2NO(g) H>0,已知该反应在2404℃时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应的正反应速率和逆反应速率的关系:v正_____v逆(填“>”、“<”或“=”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2=N2+2H2O。该电池放电时,负极的电极反应式是______________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式____________。
【答案】NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ/mol BD > N2H4+4OH- - 4e- =N2↑+4H2O N2H62++H2O[N2H5H2O]++H+
【解析】
(1)根据图像判断焓变,再写热化学方程式;
A.容器内混合气体颜色不再变化时,则气体浓度不变,达到平衡;
B.该反应为气体气体的总物质的量不变,则容器内压强不变,压强不能判断反应达到平衡;
C.化学反应速率之比等于化学计量数之比,反应到达平衡,同一物种的正逆反应速率相等,v逆(NO2)=v正(NO),达到平衡状态;
D.恒容体积不变,混合气体的质量不变,则容器内混合气体密度始终不变,密度不能说明反应到达平衡;
(2)根据Qc与K的关系判断;
(3)负极失电子,发生氧化反应,生成氮气;
(4)由N2H6Cl2与NH4Cl类似推测。
(1)由图可知,1molNO2和1molCO反应生成CO2和NO放出热量234kJ,则NO2和CO反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g) H=-234kJ/mol;
A.容器内混合气体颜色不再变化时,气体浓度不变,达到平衡,与题意不符,A错误;
B.该反应为气体气体的总物质的量不变,则容器内压强不变,压强不能判断反应达到平衡,符合题意,B正确;
C.化学反应速率之比等于化学计量数之比,反应到达平衡,同一物种的正逆反应速率相等,v逆(NO2)=v正(NO),达到平衡状态,与题意不符,C错误;
D.恒容体积不变,混合气体的质量不变,则容器内混合气体密度始终不变,密度不能说明反应到达平衡,符合题意,D正确;
答案为BD;
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,Qc=![]() =9×10-4<K,则反应应向正反应方向进行,则v正大于v逆;
=9×10-4<K,则反应应向正反应方向进行,则v正大于v逆;
(3)肼--空气燃料电池是一种碱性燃料电池工作时,负极发生氧化反应,负极反应式为N2H4+4OH- - 4e- =N2↑+4H2O;
(4)由N2H6Cl2与NH4Cl类似,而N2H4是二元碱而NH3是一元碱,则盐酸肼第一步水解反应的离子方程式为N2H62++H2O[N2H5H2O]++H+。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯的主要装置如图所示:
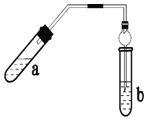
主要步骤:
①在 a 试管中 按 2:3:2 的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按 A 图连接装置,使产生的蒸气经导管通到 b 试管所盛的饱和碳酸钠溶液中;
③小火加热 a 试管中 的混合液;
④等 b 试管中收集到约 2mL 产物时停止加热。撤下 b 试管并用力振 荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
⑴实验室配制混合物加入试剂顺序:______。
⑵步骤![]() 中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
⑶A 装置中使用球形干燥管除起到冷凝作用外,另一重要作用是______,步骤![]() 中分离乙 酸乙酯必须使用的一种仪器是______。
中分离乙 酸乙酯必须使用的一种仪器是______。
⑷为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图 A 所示装置进行了以下 4 个实验。实验开始先用酒精灯微热 3min,再加热使之微微沸腾 3min。实验结束后充分振荡小试管 b 再测 有机层的厚度,实验记录如下:
实验编号 | 试管 a 中试剂 | 试管 b 中试剂 | 测得有机层的厚度/cm |
W | 3mL 乙醇、2mL 乙酸、2mL 18mol/L 浓硫酸 | 饱和 Na2CO3 溶液 | 5.0 |
X | 3mL 乙醇、2mL 乙酸 | 0.1 | |
Y | 3mL 乙醇、2mL 乙酸、2mL3mol/LH2SO4 | 1.2 | |
Z | 3mL 乙醇、2mL 乙酸、盐酸 | 1.2 |
①实验 Y 的目的是与实验 Z 相对照,证明H+ 对酯化反应具有催化作用。实验 Z 中应加入盐酸的体积 和浓度分别是______mL 和______mol/L
②分析实验______![]() 填实验编号
填实验编号![]() 的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为______![]() 填字母
填字母![]() 。
。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)=N2O4(l) ΔH1;
②N2(g)+2H2(g)=N2H4(g) ΔH2;
③O2(g)+2H2(g)=2H2O(g) ΔH3;
④2N2H4(g)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4 =___________(用含ΔH1、ΔH2、ΔH3的代数式表示)
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)H2(g)+CO2(g),得到如下表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
2 | 900 | 1 | 2 | 0.4 | 0.6 | 3 |
3 | 900 | a | b | c | d | t |
① 该反应为________(填“吸热”或“放热”)反应;实验2的平衡常数K= _________。
② 若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4mol H2O(g),使反应达到新平衡,下列说法不正确的是_______。
A.新旧平衡时容器气体压强之比为5:3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-1
D.新旧平衡时容器气体密度之比为5:3
(3)室温下,用0.1 mol·L-1的KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
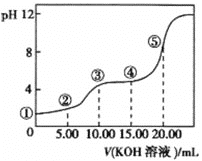
①点②所示的溶液中的电荷守恒式为_____________。
②点③所示溶液中各离子浓度由大到小的顺序为___________。
③点④所示溶液中c(K+) + c(H2C2O4 ) + c(![]() ) + c(
) + c(![]() ) =_______ mol·L-1。
) =_______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)ClO2是一种高效安全的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
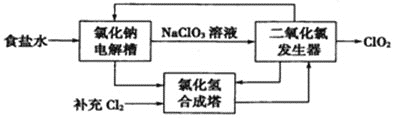
①写出氯化钠电解槽内发生反应的离子方程式:________________________。
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:_____________。
(2)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:
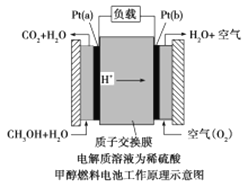
请回答下列问题:
Pt(a)电极是电池的_______极,电极反应式为______________________;
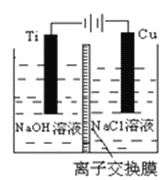
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.1molCH2=CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl22.5mol
B.实验室中可用如图所示方法除去CH3CH3气体中的CH2=CH2气体
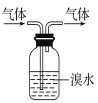
C.实验室中可用酸性的KMnO4溶液鉴别CH3CH3气体和CH2=CH2气体
D.工业上可利用CH2=CH2与HCl的加成反应制得纯净的CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
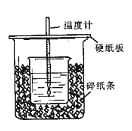
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业利用菱镁矿(主要含MgCO3,还含有Al2O3、FeCO3杂质)制取氯化镁的工艺流程。
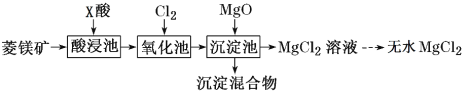
下列说法不正确的是( )
A.酸浸池中加入的X酸是硝酸
B.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
C.沉淀混合物为Fe(OH)3和Al(OH)3
D.在工业上常利用电解熔融氯化镁的方法制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
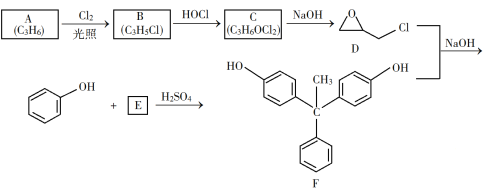
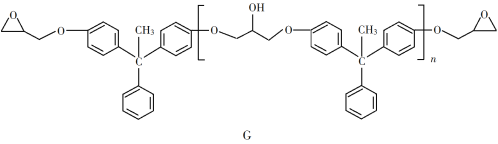
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
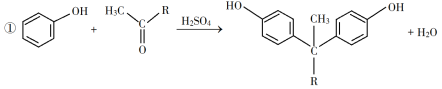
已知以下信息:
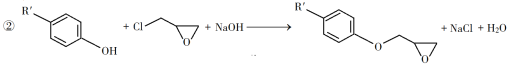
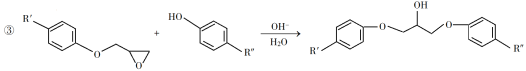
(1)A是一种烯烃,化学名称为__________。
(2)由B生成C的反应类型为__________。
(3)由C生成D的反应方程式为__________。
(4)E的结构简式为__________。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式_____、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765 g,则G的n值理论上应等于__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
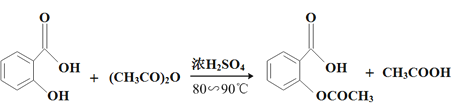
【题目】阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
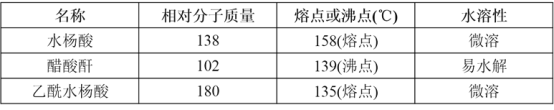
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是___。
(2)合成阿司匹林时,最合适的加热方法是___。
(3)提纯粗产品流程如下,加热回流装置如图:


①使用温度计的目的是控制加热的温度,防止___。
②冷凝水的流进方向是___(填“a”或“b”)。
③趁热过滤的原因是___。
④下列说法不正确的是___(填字母)。
A.此种提纯方法中乙酸乙酯的作用是做溶剂
B.此种提纯粗产品的方法叫重结晶
C.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
D.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为___%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com