
已知:A、B、C、D、E是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道 上只有两个电子, C元素的基态原子L层只有2对成对电子,D元素在第三周期元素中电负性最大,E2+的核外电子排布和Ar原子相同。
上只有两个电子, C元素的基态原子L层只有2对成对电子,D元素在第三周期元素中电负性最大,E2+的核外电子排布和Ar原子相同。
请回答下 列问题:
列问题:
(1)分子式为BC2的空间构型为 ;D元素原子的核外电子排布式为  。
。
(2)B第一电离能比C__________(填“大”或“小”);A与B形成的最简单化合物的分子空间构型为___ _____________,其中心原子的杂化为 。
_____________,其中心原子的杂化为 。
(3)A2C所形成的晶体类型为 ;E单质所形成的晶体类型为_______。
(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化锰,有无色气体生成。则该化合物的分子 式是 ,属于 分子(填:“极性”或“非极性”),该反应的化学方程式是:_________________ __________。
式是 ,属于 分子(填:“极性”或“非极性”),该反应的化学方程式是:_________________ __________。
(5)C跟E可形成离子化合物,其晶胞结构与NaCl的晶胞相似,同为面心立方结构。该离子化合物晶体的密度为ρg·cm-3,NA表示阿伏加德罗常数,则该离子化合物晶胞的体积是 (用含ρ、NA的代数式表示)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的
4种钠盐溶液pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中, 正确的是( )
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
B.标准状况下, 11.2L苯中含有的碳碳双键数为1.5NA
11.2L苯中含有的碳碳双键数为1.5NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.5.6g铁与0.1mol氯 气在点燃条件下充分反应,转移的电子数为0.3NA
气在点燃条件下充分反应,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)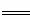 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g) 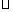 H1=-1275.6kJ·mol-1
H1=-1275.6kJ·mol-1
②2CO(g)+O2(g)  2CO2(g)
2CO2(g) 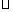 H2=-566.0kJ·mol-1
H2=-566.0kJ·mol-1
③H2O(g)=H2 O(l)
O(l) 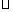 H3=-44.0kJ·mol-1
H3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应:
CH4(g)+H2O(g) CO(g)+3H2(g)
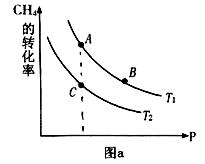
CO(g)+3H2(g) 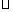 H>0
H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为 ;
②100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.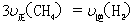
如果 达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K= 。
达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K= 。
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
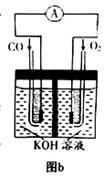
查看答案和解析>>
科目:高中化学 来源: 题型:
配平下列方程式
(1)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
 Ce3++
Ce3++ H2O2+
H2O2+ H2O===
H2O=== Ce(OH)4↓+
Ce(OH)4↓+ ________
________
(2)完成“氧化除铁”步骤中反应的离子方程式:
 Fe(OH)2+
Fe(OH)2+ ClO-+
ClO-+ ________===
________=== Fe(OH)3+
Fe(OH)3+ Cl-
Cl-
(3)配平反应的离子方程式:
 Mn2++
Mn2++ ClO
ClO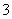 +
+ H2O===
H2O=== MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ ________。
________。
(4)配平用钙线脱氧脱磷的化学方程式:
 P+
P+ FeO+
FeO+ CaO
CaO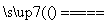
 Ca3(PO4)2+
Ca3(PO4)2+ Fe
Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
(2)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
该反应的氧化产物是______________,若有1.1mol P4反应,则有________mol电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有M、N、P、E 4种元素的单质,能发生以下反应①在水溶液中,M+N2+===M2++N
②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相连浸入稀H2SO4中,电极反应为:N-2e-===N2+,2H++2e-===H2↑ 判断它们的还原性由强到弱的顺序是 ( )
A.M、N、P、E B.P、M、N、E C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠可作为脱氯剂,已知25.0mL0.100 mol·L-1Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl—离子,则将S2O32-转化成( )
A.S2— B.S C.SO32- D. SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com