
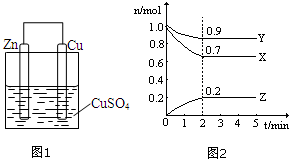
 (1)设计的原电池如图1所示,回答下列问题:
(1)设计的原电池如图1所示,回答下列问题:| △c |
| △t |
| ||
| 2min |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
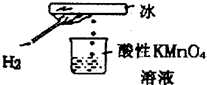 某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )
某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )| A、该条件下生成的水分子化学性质比较活泼 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C、该条件下H2燃烧生成了具有还原性的物质 |
| D、该条件下H2燃烧的产物中可能含有一定量的H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子中有一个sp2-sp2σ键和一个p-p π键 |
| B、乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键 |
| C、乙烷两个C原子均是sp3杂化,分子中一共有6个σ键 |
| D、苯分子每个碳原子均是sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、②③⑥ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液.(该过程中不考虑两球浮力的变化)下列说法正确的是( )
如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液.(该过程中不考虑两球浮力的变化)下列说法正确的是( )| A、若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低 |
| B、若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低 |
| C、若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低 |
| D、无论杠杆由绝缘体材料还是由导体材料制成,一段时间后,杠杆一定A端高B端低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Na+、Br- |
| B、NH4+、Na+、AlO2- |
| C、Ba2+、Al3+、Cl- |
| D、K+、Mn4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该物质由碳、氢、氧三种元素组成 |
| B、该物质的化学式为H2O2 |
| C、该物质中氢、氧元素的质量比1:8 |
| D、该物质中氢元素的质量分数为5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 | ||
| B、不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上小苏打溶液 | ||
C、在加热的情况下,试管中的液体体积不要超过试管容积的
| ||
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钠钾是活泼的碱金属,过氧化钠(Na2O2)、过氧化钾(K2O2)和超氧化钾(KO2) 在医院、矿井、潜水、高空飞行中用作供氧剂.某航天飞行器座舱内空气更新过程如图所示:
钠钾是活泼的碱金属,过氧化钠(Na2O2)、过氧化钾(K2O2)和超氧化钾(KO2) 在医院、矿井、潜水、高空飞行中用作供氧剂.某航天飞行器座舱内空气更新过程如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com