
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A+N+m)mol | B. | $\frac{a}{A+m}$(A-N+m)mol | C. | $\frac{a}{A+m}$( A-N)mol | D. | $\frac{a}{A+m}$(A-N)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
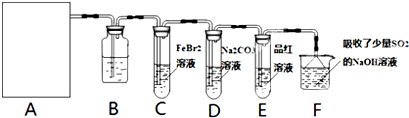
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
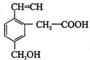 某机物的结构如图所示,这种有机物不可能具有的性质是( )
某机物的结构如图所示,这种有机物不可能具有的性质是( )| A. | ①④ | B. | ②⑤ | C. | ②⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
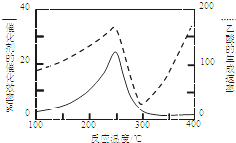 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法不正确的是( )| A. | H2O的分解反应是吸热反应 | |
| B. | 过程①是太阳能转换成化学能 | |
| C. | 过程②是化学能转换为电能 | |
| D. | 氢气不易贮存和运输,无开发利用价值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com