
����Ŀ����ʽ̼��ͭ������������;�㷺�Ļ���ԭ�ϡ�
��1����ҵ�Ͽ������Կ�ʴ��Һ����Ҫ�ɷ���Cu2+��Fe2+��Fe3+��H+��Cl���Ʊ���ʽ̼��ͭ�����Ʊ��������£�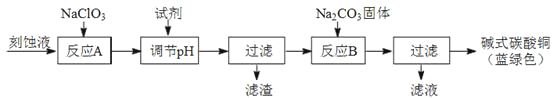
��֪��Cu2+��Fe2+��Fe3+���ɳ�����pH���£�
���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
��ʼ����pH | 4��2 | 5��8 | 1��2 |
��ȫ����pH | 6��7 | 8��3 | 3��2 |
�������Ƶ���������
�ڷ�ӦA�������Һ��pH��ΧӦΪ��
�۵�һ�ι��˵õ��IJ�Ʒϴ��ʱ������ж��Ѿ�ϴ������
���������ɫ��Ʒ�л���CuO���ʵ�ԭ������
��2��ijѧϰС����ʵ������������ͼ��ʾװ����ȡ������̽�������ʡ�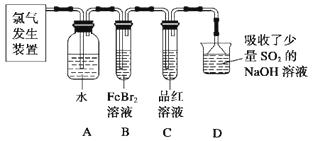
��ʵ�����ö������̺�Ũ���������ȡ����������������Ҫ��©����
����C��Ʒ����Һ��ɫ���ܷ�֤��������ˮ��Ӧ�IJ�����Ư���ԣ�˵��ԭ������ʱBװ���з�����Ӧ�����ӷ���ʽ����
��д��A��Һ�о���ǿ���������Ļ�ѧʽ������A��Һ�м���NaHCO3��ĩ����۲쵽����������
���𰸡�
��1����Fe2+������Fe3+�����ճ�ȥ����3��2��4��2����ȡ���һ��ϴ��Һ��������������ϡ���ᣬ���������������ϴ�Ӹɾ�������ӦB���¶ȹ��ߡ�
��2����Һ©��������֤������ΪCl2Ҳ�������ԣ���ʵ����ȷ����Cl2����HClOƯ�ף�2Fe2����4Br����3Cl2=2Fe3����6Cl����2Br2������ɫ�������
����������1���û�ѧ��������Ŀ�������Է�Һ�Ʊ���ʽ̼��ͭ�������ȥ��Һ��Fe3+��Fe2+ �� ��������������ݣ��轫Fe2+����ΪFe3+,������Cu2+���뿪����ʴ��Һ����NaClO3 �� ���ķ�ӦA��Fe2+����ΪFe3+ �� ����pH��Χ��3��2-4��2��Fe3+ת��Ϊ�����������������ˣ���Һ�м���̼���ƾ���ӦB���ɼ�ʽ̼��ͭ�����˵ò�Ʒ���ж�ϴ���ķ����ǣ�ȡ���һ��ϴ��Һ��������������ϡ���ᣬ���������������ϴ�Ӹɾ����������ɫ��Ʒ�л���CuO���ʵ�ԭ���ǣ���ӦB���¶ȹ��ߡ���2����ʵ�����ö������̺�Ũ���������ȡ����Ϊ��Һ�����������װ�ã�����������Ҫ��©���з�Һ©��������C��Ʒ����Һ��ɫ������֤��������ˮ��Ӧ�IJ�����Ư���ԣ�ԭ������ΪCl2Ҳ�������ԣ���ʵ����ȷ����Cl2����HClOƯ�ף�C��Ʒ����Һ��ɫ��˵��װ��B�������ѹ�������ʱBװ�����������Ӻ������Ӿ������������ӷ���ʽ��2Fe2����4Br����3Cl2=2Fe3����6Cl����2Br2����������ˮ��Ӧ��������ʹ����ᣬ�÷�ӦΪ���淴Ӧ��������Ϊ���ᣬ��A��Һ�о���ǿ���������Ļ�ѧʽ��Cl2��HClO��ClO-������A��Һ�м���NaHCO3��ĩ�������̼�����Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����۲쵽������������ɫ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ��ʾ������һ���Ǵ�������ǣ� ��
A.C2H6O
B.C2H4Cl2
C.CH4O
D.C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС����������´Ӻ������պ�ĺ���������ȡ�ⵥ�ʵ����̣� 
��1���ܽ⺣����ʱҪ�������2��3min��Ŀ���� �� ����a������Ϊ ��
��2�����ữ����ҺI�м���H2O2��Ŀ��Ϊ ��
��3����֪I2��40%��NaOH��Һ��Ӧ���ɵ���������ͻ�ԭ��������ʵ���֮��Ϊ1��5��д����Ӧ�Ļ�ѧ����ʽ ��
��4�������˵õ���I2��Ҫ����ϴ�Ӻ������ϴ�Ӽ�����Ӧ��ѡ�õ�������ѡ����ĸ����
A.ˮ
B.�Ҵ�
C.��ˮ
D.�Ҵ���ˮ��Һ
��5����Na2S2O3�ı���Һ�ⶨ��Ʒ�Ĵ��ȣ�������Ӧ��I2+2Na2S2O3=Na2S4O6+2NaI��ȡ5.0g��Ʒ�����Ƴ�100mL��Һ��ȡ10.00mL��Һ���Ե�����ҺΪָʾ������Ũ��Ϊ0��.050molL��1Na2S2O3�ı���Һ���еζ���������ݼ�¼���±���ʾ��
��� | 1 | 2 | 3 |
��Һ�����/mL | 10.00 | 10.00 | 10.00 |
����Na2S2O3����Һ�����/mL | 19.95 | 17.10 | 20.05 |
�ζ�ʱ���ﵽ�ζ��յ�������� �� �ⵥ���ڲ�Ʒ�е��������������ðٷ�����ʾ���ұ���1λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��Ϊ�ⶨһ��������ijͭ���������ͭ���������������������ʵ�鷽����
������ͭ������� ![]() �ⶨ������������
�ⶨ������������
������ͭ������� ![]() �ⶨʣ����������
�ⶨʣ����������
�����й��ж��в���ȷ���ǣ� ��
A.��ҺA��B�������������NaOH��Һ
B.����ҺBѡ��Ũ���ᣬ����ͭ����������ƫС
C.��ҺA��B����ѡ��ϡ����
D.ʵ�����з����������ʵʩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.������ﶼ�ܷ���ˮ��
B.�����ᡢ���۾����ڸ߷��ӻ�����
C.ֲ���͵���Ҫ�ɷ��Ǹ�֬����
D.���ǡ���ѿ�ǵķ���ʽ����C12H22O11������Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ͨ����ѧ�仯����ʵ��16O��18O֮���ת��
B. ��ΪH2O�ķе����H2S������Oԭ�ӵõ�����������Sԭ��
C. ij����������״̬���ܵ��磬�û�������һ�������Ӽ�
D. 16O2��18O2��Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У��ɼӳɷ�Ӧ�������
A.��ϩͨ�����Ը��������Һ�У����������Һ��ɫ
B.�ɵ�ʯ����Ȳ
C.һ�������£�������Ũ�����Ũ����Ļ��Һ�У�����״������
D.����һ���¶ȡ�ѹǿ�ʹ����������º�������Ӧ�����ɻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ�������
A. ������������ͭ�Լ�����ij�����Ƿ�����
B. ��ֲ�����е�����ˮ����ˮ��ɫ
C. �ڼ�������Һ�е���ŨHNO3���Ȼ������ɫ����
D. ø�����ڵ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com