
 ;
;分析 As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,As元素的化合价降低,则As2O3为氧化剂,被还原,还原产物为AsH3;Zn元素的化合价升高,Zn元素被氧化,则ZnSO4为氧化产物,以此来解答.
解答 解:(1)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,每个Zn原子失去2个电子,6个Zn失去12个电子,As元素得到12个电子,则双线桥法标出电子转移的方向和数目为 ;
;
故答案为: ;
;
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中,As元素的化合价降低,则As2O3为氧化剂,表现氧化性,故答案为:A;
(3)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中中,As元素的化合价降低,则As2O3为氧化剂,被还原,还原产物为AsH3;Zn元素的化合价升高,Zn元素被氧化,则ZnSO4为氧化产物,
故答案为:ZnSO4;AsH3;
(4)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中生成1molAsH3转移6mol电子,则生成0.1molAsH3,则转移的电子数为0.6mol电子,即转移的电子数为0.6NA;
故答案为:0.6NA.
点评 本题考查氧化还原反应及计算,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
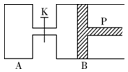 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.
已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
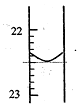 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
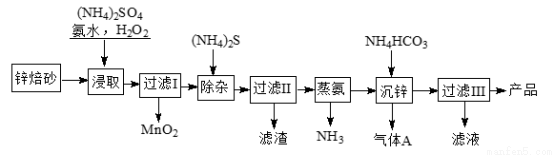
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com