


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
| A、0.5×(10-14+10-12) mol?L-1 |
| B、5×(10-15+10-11) mol?L-1 |
| C、2.0×10-1 mol?L-1 |
| D、2.0×10-14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
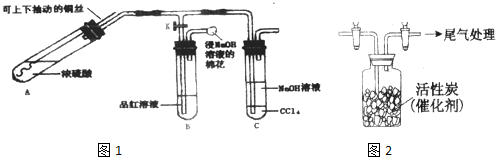
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
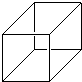 “立方烷”是一种新合成的烃,其分子为正立方体结构,其碳骨架结构如图所示:
“立方烷”是一种新合成的烃,其分子为正立方体结构,其碳骨架结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
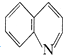 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: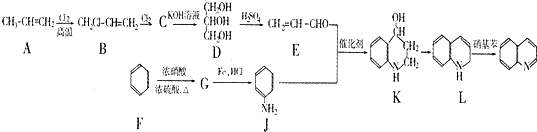
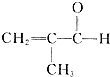 制备物质K的同系物:
制备物质K的同系物:查看答案和解析>>
科目:高中化学 来源: 题型:
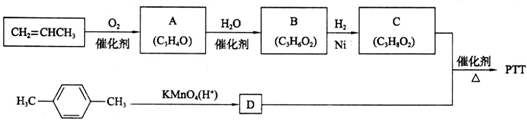
| CI2 |
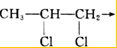
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计测定浓度均为0.1mol/L NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 室温下,向两支装有同体积同浓度H2O2溶液的试管中,分别加入3滴同浓度的 CuSO4、FeSO4溶液 | 比较CuSO4、FeSO4作为催化剂对H2O2分解速率的影响 |
| C | 向0.1mol/L AgNO3溶液中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化 | 比较AgCl、AgI的溶解度相对大小. |
| D | 向含有少量FeCl3的MgCl2酸性溶液中加入足量Mg(OH)2,加热并搅拌,过滤 | 除去MgCl2酸性溶液中含有的少量FeCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
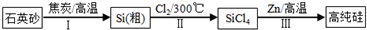
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com