
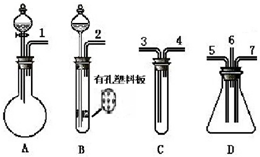
 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:分析 验证SO2既有氧化性又有还原性的实验,由图可知,A中发生①③物质的反应生成SO2,B中发生①④物质的反应生成H2S,在C中加溴水,1与3相连,溴水褪色,发生SO2+Br2+2H2O=H2SO4+2HBr;4与5相连,同时2与7相连,二氧化硫与硫化氢均进入D中发生2H2S+SO2=3S↓+2H2O,为防止污染环境,然后出气口6与3相连,此时C中为NaOH溶液进行尾气处理,以此来解答.
解答 解:验证SO2既有氧化性又有还原性的实验,由图可知,A中发生①③物质的反应生成SO2,B中发生①④物质的反应生成H2S,在C中加溴水,1与3相连,溴水褪色,发生SO2+Br2+2H2O=H2SO4+2HBr;4与5相连,同时2与7相连,二氧化硫与硫化氢均进入D中发生2H2S+SO2=3S↓+2H2O,然后出气口6与3相连,此时C中为NaOH溶液进行尾气处理,
(1)由上述分析可知,上述仪器组合成整套装置,装置顺序为A、C、D(同时连B、D)、C,则正确的连接顺序是1→3→4→5→6→7,
故答案为:1→3→4→5→6→7;
(2)由上述分析可知,A中试剂为①③,B中试剂为①④,C中分别试剂为②或⑥,
故答案为:①③;①④;②或⑥;
(3)A中发生①③物质的反应生成SO2,其反应方程式为:Na2SO3+2HCl=2NaCl+H2O+SO2↑,B中发生①④物质的反应生成H2S,其反应方程式为:FeS+2HCl=H2S↑+FeCl2,
故答案为:Na2SO3+2HCl=2NaCl+H2O+SO2↑;FeS+2HCl=H2S↑+FeCl2;
(4)S元素的化合价降低,体现二氧化硫的氧化性,观察到装置内壁上有淡黄色的固体析出和液滴生成,其反应方程式为:2H2S+SO2=3S↓+2H2O;
故答案为:D;装置内壁上有淡黄色的固体析出和液滴生成;2H2S+SO2=3S↓+2H2O;
(5)C中发生SO2+Br2+2H2O=H2SO4+2HBr,S元素的化合价升高,体现二氧化硫的还原性,观察到溴水褪色;
故答案为:C;溴水褪色;SO2+Br2+2H2O=H2SO4+2HBr;
(6)该实验中二氧化硫、硫化氢、溴蒸气均为有毒气体,严重污染大气,必须净化后再放空,则装置D的出气管应连接盛有NaOH溶液的C装置3口,
故答案为:装置D的出气管应连接盛有NaOH溶液的C装置3口.
点评 本题考查性质实验方案的设计,把握还原性与氧化性的实验中发生的化学反应进行实验设计为解答的关键,注重氧化还原反应、实验技能、化学与环境的综合考查,题目难度中等.题目侧重考查了学生设计实验的能力、分析问题解决问题的能力及提取信息的能力.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
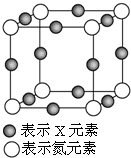 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 反应前后有元素化合价变化的反应一定是氧化还原反应 | |
| D. | 金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com