
| m |
| M |
| 32g |
| 32g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W | M |
查看答案和解析>>
科目:高中化学 来源: 题型:
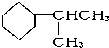
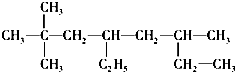
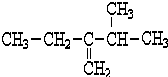
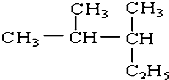
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容后,又重新加水至刻度线 |
| B、烧杯和玻璃棒的溶液未转入容量瓶中 |
| C、定容时,眼睛俯视刻度线 |
| D、容量瓶洗净后没有干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依据电荷守恒,推测一定存在K+和NH4+ |
| B、100mL溶液中含0.01mol CO32- |
| C、Ba2+一定不存在,Mg2+可能存在 |
| D、2.33g沉淀中含BaCO3和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Al(SO4)2溶液中加过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| B、NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、四氧化三铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| D、碘化钾溶液酸化后滴入少量双氧水:2I-+2H++H2O2═I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com