
(10分)某氯化铁样品含有FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:
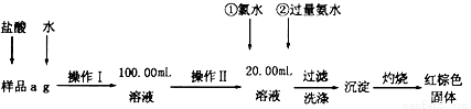
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 (填仪器名称).
(2)加入过量氨水生成沉淀的离子方程式为 ;
(3)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(4)步骤⑤中检验沉淀是否洗净的方法是 。
(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
(1)100mL容量瓶、胶头滴管;(2)Fe3+ + 3NH3·H2O = Fe(OH)3↓ + 3NH4+;(3)A、C;
(4)取最后一次洗涤液于试管中,加入AgNO3溶液,溶液不变浑浊,说明沉淀洗涤干净。
(5)7(W2-W1) /10m×100%
【解析】
试题分析:(1)操作I是配制一定浓度一定体积的溶液,除了所用到的玻璃仪器除烧杯、玻璃棒外,还必须有100mL容量瓶、胶头滴管;(2)加入过量氨水,会形成Fe(OH)3沉淀,一水合氨是弱碱,应该写化学式,所以反应生成沉淀的离子方程式为Fe3+ + 3NH3·H2O = Fe(OH)3↓ + 3NH4+;(3)若不用氯水,由于氧化性Fe3+>I2,H2O2 >Fe3+;NaClO>Fe3+;所以可用的试剂是A.H2O2 、C.NaClO;(4)若沉淀洗涤干净,则洗涤溶液中不含有Cl-,因此步骤⑤中检验沉淀是否洗净的方法是取最后一次洗涤液于试管中,加入AgNO3溶液,溶液不变浑浊,说明沉淀洗涤干净。(5)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,则m(Fe2O3)=( W2- W1)g,样品中铁元素的质量分数为{[( W2- W1)g÷160g/mol]×2×56g/mol}÷a×100%=7(W2-W1) /10m×100%.
考点:考查物质的量浓度的溶液的配制、离子方程式的书写、物质的选择及含量的计算的知识。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.SO2、SiO2、NO2均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.“玉兔”月球车太阳能电池帆板的材料是二氧化硅
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-)
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是 ( )
A.NH4+、Na+、Ba2+、Cl- B.Na+、I-、HCO3-、SO42-
C.K+、Cl-、SO32-、AlO2- D.Na+、Mg2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
下列反应最终能生成Fe3+的化合物的是
①过量Fe与HNO3 ②铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2015届山东省菏泽市高三上学期期中联考化学试卷(A)(解析版) 题型:选择题
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是
A.2Fe2++Cl2=2Fe3++2Cl-
B.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.SO2+I2+2H2O=H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性
②取少量溶液中入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体
③在上述溶液中再滴加Ba(NO3) 3溶液,产生白色沉淀
④取上层清液继续滴加Ba(NO3) 3溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀
根据实验以下推测正确的是 ( )
A.一定有SO32-离子 B.一定有CO32-离子
C.Cl-离子一定存在 D.不能确定HCO3-离子是否存在
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强
B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:Fe3+ > Cu2+ > Fe2+
C.已知还原性:B-> C-> D-,反应 2C-+ D2 = 2D-+C2和反应 2C-+ B2 = 2B-+C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届山东省聊城市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
在给定条件下,下列加点的物质在化学反应中完全消耗的是( )
A.用50mL 12 mol·L-1的氯化氢水溶液与足量二氧化锰共热制取氯气
B.将1g铝片投入20mL 18.4 mol·L-1的硫酸中
C.向100mL 3 mol·L-1的硝酸中加入5.6g铁
D.常温常压下,0.1mol氯气通入1L水中反应
查看答案和解析>>
科目:高中化学 来源:2015届山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+1、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,该反应中是 元素被还原 。
2Cu+SO2反应制取粗铜,该反应中是 元素被还原 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为: 温度控制在50℃-60℃的原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)现向Cu、Cu2O和CuO组成的混合物中,加入2 L 0.6 mol·L-1 HNO3溶液恰好使混合物溶解,同时收集到4480 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.2 mol Cu,将该混合物与稀硫酸充分反应,消耗H2SO4的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com