
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 :
: 分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,
(1)稀有气体化学性质最不活泼;氟元素没有最高正化合价;非金属性越强,单质氧化性越强,金属性越强,单质还原性越强;
(2)Na的金属性最强,则NaOH碱性增强,F元素没有含氧酸,高氯酸的酸性增强,氢氧化铝是两性氢氧化物;
(3)同周期自左而右非金属性最强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(4)同周期随原子序数增大元素原子半径减小,
(5)E的单质为氮气,氮气分子中含有1个氮氮三键;
(6)化合物BG为NaF,氟化钠为离子化合物,阴阳离子需要标出所带电荷.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,
(1)稀有气体Ne的化学性质最不活泼;氟元素没有最高正化合价;上述元素中,F同时非金属性最强,故F2的氧化性最强,Na的金属性最强,故Na单质还原性最强,
故答案为:Ne;F;F2;Na;
(2)上述元素中,Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,F元素没有含氧酸,高氯酸的酸性增强,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,
故答案为:NaOH;HClO4;Al(OH)3;
(3)同周期自左而右非金属性最强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,C、N、P、F、Cl中F的非金属性最强,则HF最稳定,
故答案为:HF;
(4)电子层数越多,半径越大,同周期随原子序数增大元素原子半径减小,则原子半径大小为:Na>Al>P>Cl>N>C,即原子半径最大的为Na,
故答案为:Na;
(5)E的单质为氮气,氮气分子中含有氮氮三键,其结构式为N≡N,
故答案为:N≡N;
(6)BG组成的化合物为NaF,NaF为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表和元素周期律的应用,题目难度中等,明确元素周期表的结构为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
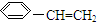 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
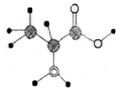 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
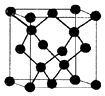 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 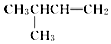 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 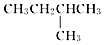 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com