
【题目】按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )

A.F表示反应生成Cu的物质的量
B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
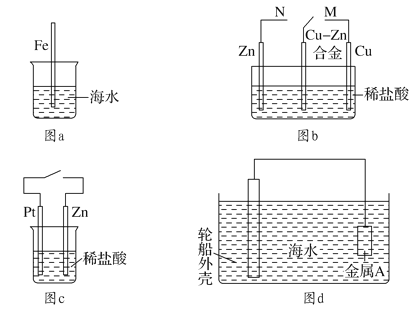
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
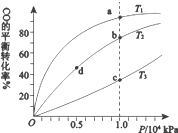
A.温度:T1>T2>T3
B.正反应速率:v(b)>v(d) v(a)>v(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的两组装置,回答下列问题:
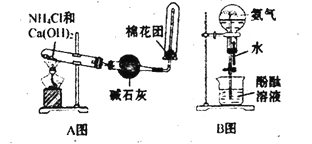
(1)用A图所示的装置可制备干燥的NH3,反应的化学方程式为:___。干燥管中干燥剂能否改用无水CaCl2?__。(填“能”或“不能”)检验NH3是否收集满的实验方法是:__。氨气溶于水呈碱性的原因是:___。
(2)若要配制100mL9.0mol/L的氨水,用到的玻璃仪器有烧杯、玻璃棒、量筒、___、__。
(3)将等浓度、等体积的氨水和盐酸混合,所得溶液中离子浓度从大到小的顺序为___。
(4)用B图所示的装置可进行喷泉实验,上部烧瓶已充满干燥氨气,引发水上喷的操作是__,该实验的原理是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)证明溴乙烷中溴元素的存在,有下列几步,其正确的操作顺序是___。
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性
(2)有机物M结构如图,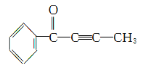 。根据M的结构回答:最多有__个原子共平面。
。根据M的结构回答:最多有__个原子共平面。
(3)某烃A和炔烃B的混合物共1L,完全燃烧生成相同状况下的二氧化碳1.4L,水蒸气1.6L,写出两种烃的结构简式A__,B___。
(4)实验室制取硝基苯的化学反应方程式是___。
(5)溴乙烷水解得到乙醇,乙醇可以发生催化氧化成醛,写出乙醇催化氧化的方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)晶体硅中Si原子的杂化方式是___,基态Ga原子核外电子排布式为___。
(2)向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为____。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___。
(3)某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与____个S原子相连,含铜化合物的化学式为____。设NA为阿伏加德罗常数的值,则该晶胞的密度为___gcm3(用含a、b、NA的代数式表示)。
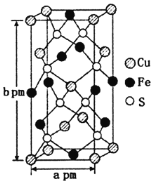
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示原电池的盐桥中装有饱和K2SO4溶液,电池工作一段时间后,甲烧杯中溶液颜色不断变浅。下列叙述中正确的是

A. b极是电池的正极
B. 甲烧杯中K+经盐桥流向乙烧杯
C. 甲烧杯中溶液的pH逐渐减小
D. 电池的总反应离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1mol O2 | 4molSO3 | 2molSO2、1mol O2 |
平衡v正(SO2)/ mol·L-1 ·s-1 | v1 | v2 | v3 |
平衡c(SO3)/ mol·L-1 | c1 | c2 | c3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(O2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是 ( )
A.v1<v2,c2<2c1B.K1>K3 ,p2>2p3
C.v1<v
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:
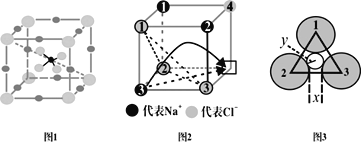
(1)S+2e-=S2-过程中,获得的电子填入基态S原子的___(填轨道符号);
(2)BF3+NH3=NH3BF3的反应过程中,形成化学键时提供电子的原子轨道符号是___;产物分子中采取sp3杂化轨道形成化学键的原子是___;
(3)基态Li+、B+分别失去一个电子时,需吸收更多能量的是___,理由是___;
(4)图1所示的晶体中,锂原子处于立方体的位置___;若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
(6)温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Na+)=95pm,r(Cl-)=185pm,![]() =1.4,
=1.4,![]() 。
。
①x=___,y=___;(保留一位小数)
②迁移可能性更大的途径是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com