
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。
【答案】第二周期第ⅥA族 ![]() O2 S2->Cl->O2->Al3+ MnO2+4H++2Cl-
O2 S2->Cl->O2->Al3+ MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 2NH3H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O
Mn2++Cl2↑+2H2O 2NH3H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O
【解析】
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A与氧元素能形成两种无色气体,为CO、CO2,则A为C元素;结合A、E在元素周期表中的相对位置可知E为S元素;C是地壳中含量最多的元素,C为O元素,则B只能为N元素;D是地壳中含量最多的金属元素,D为Al元素,F的原子序数最大,F只能为Cl元素,据此分析解答。
根据上述分析,A为C元素,B为N元素,C为O元素,D为Al元素,E为S元素,F为Cl元素。
(1)C为O,在元素周期表中位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)AE2的分子式为CS2,与二氧化碳结构相似,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)常温下S为固体,氧气与氯气均为气体,相对分子质量大的沸点高,则C、E、F的单质沸点最低的是O2,故答案为:O2;
(4)电子层越多,离子半径越大,具有相同电子排布的离子中,原子序数大的离子半径小,则C、D、E、F的离子半径由大到小的顺序是S2->Cl->O2->Al3+,故答案为:S2->Cl->O2->Al3+;
(5)实验室用二氧化锰与浓盐酸加热制取Cl2,反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(6)B的最简单气态氢化物为NH3,其水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,反应生成氮气与水,反应的化学方程式为:2NH3H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O,故答案为:2NH3H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是__________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2溶液和0.1 mol·L-1NH4HSO4溶液中的c(![]() ),前者_____后者。(填“等于”、“大于”或“小于”)
),前者_____后者。(填“等于”、“大于”或“小于”)
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
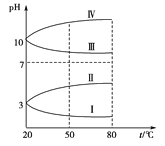
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填字母),导致pH随温度变化的原因是__________________;
②20 ℃时,0.1 mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________点;在b点,溶液中各离子浓度由大到小的排列顺序是_________________________。
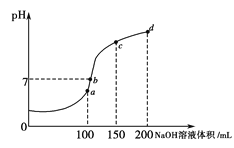
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的分子式是C6H8O4,关于该分子的结构推测合理的是
A. 可能含有1个苯环
B. 可能含有两个碳碳三键和4个羟基
C. 可能含有2个羧基和1个碳碳双键
D. 可能含有1个醛基、1个羧基、1个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态价电子排布图为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用容量瓶配制溶液时,由于操作不当,会引起误差。下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,俯视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①②⑤B. ①③⑤C. ③④⑤D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
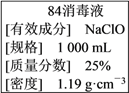
(1)消毒液”的物质的量浓度约为______ mol·L-1。
(2)某同学取100 mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
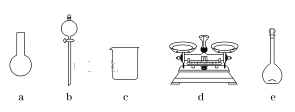
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、E、F是三个不同短周期的五种主族元素,其原子序数依次增大。A和E最外层电子数相同,1mol单质E跟足量酸完全反应时,产生标准状况下11.2L氢气;C2-与E+具有相同的电子层结构;B、C和F在周期表中相邻,B、C同周期,C、F同主族;请回答下列问题:
(1)写出E元素在周期表中的位置:______
(2)画出F原子的结构示意图:______
(3)用电子式表示化合物E2C的形成过程:______
(4)写出金属铜与元素F的最高价氧化物的水化物的浓溶液在加热条件下反应的化学方程式______
(5)A、B两种元素形成的离子型化合物的化学式为:______
(6)P和Q两种物质都是由A、C、E、F四种元素组成的酸式盐,等物质的量的P和Q恰好完全反应,写出该反应的离子方程式:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
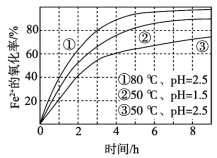
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com