分析:(1)硫酸铝和碳酸氢钙都是强电解质,在溶液中完全电离,电离方程式用等号;
(2)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;
在水溶液中完全电离的是强电解质;部分电离的是弱电解质;
(3)氧化剂发生还原反应;还原剂发生氧化反应,生成氧化产物,根据元素的化合价变化进行分析判断;
由反应可知生成3mol气体转移6mol电子,以此进行计算;
(4)①由n=
计算气体物质的量,原子物质的量为气体分子2倍,再根据N=nN
A计算原子数目;
②根据ω=
×100%计算出该溶液中溶质的质量分数.
解答:
解:(1)硫酸铝为强电解质,在溶液中完全电离出硫酸根离子和铝离子,电离方程式为:Al
2(SO
4)
3=2Al
3++3SO
42-,
碳酸氢钙为强电解质,在溶液中完全电离出碳酸氢根离子和钙离子,电离方程式为:Ca(HCO
3)
2=Ca
2++2HCO
3-,
故答案为:Al
2(SO
4)
3=2Al
3++3SO
42-;Ca(HCO
3)
2=Ca
2++2HCO
3-;
(2)①NaCl溶液是混合物,能导电,既不是电解质也不是非电解质;
②干冰不能导电,且自身不能电离,是非电解质;
③冰醋酸不能导电,在水溶液中部分电离,能够导电,是弱电解质;
④铜金属单质,存在自由移动的电子,能导电,既不是电解质也不是非电解质;
⑤BaSO
4固体不能导电,在熔融状态下能够导电,溶于水的部分完全电离,是强电解质;
⑥酒精不能导电,是非电解质;
⑦熔融的KNO
3能导电,在水溶液中完全电离,是强电解质;
⑧氨水是混合物,能导电,既不是电解质也不是非电解质;
⑨盐酸是混合物,能导电,既不是电解质也不是非电解质;
⑩液氨不能导电,是非电解质;
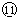
液态HCl不能导电,在水溶液中完全电离,是强电解质;
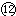
NaOH固体不能导电,在水溶液中完全电离,是强电解质;
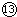
Na
2SO
4?10H
2O不能导电,在水溶液中完全电离,是强电解质;
故能够导电的是①④⑦⑧⑨;属于强电解质但在上述状态下不导电的是⑤
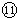
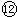
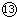
;属于非电解质的是②⑥⑩,
故答案为:①④⑦⑧⑨;⑤
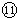
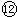
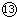
;②⑥⑩;
(3)H
2O
2 发生的过程:H
2O
2→O
2中O元素化合价升高,因此H
2O
2 作还原剂,被氧化生成氧气,故氧气为氧化产物;
H
2CrO
4发生的过程:H
2CrO
4→Cr(OH)
3中Cr元素化合价降低,因此H
2CrO
4作还氧化剂;
反应方程式为:2H
2CrO
4+3H
2O
2═2Cr(OH)
3↓+3O
2↑+2H
2O,根据方程式可知:生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为
×3mol=0.15mol,即标准状况下的体积为22.4×0.15=3.36L;
故答案为:H
2CrO
4和O
2,3.36;
(4)①mg气体的物质的量=
=
mol,由双原子分子构成,原子物质的量为气体分子2倍,故含有原子数目=
mol×2×N
Amol
-1=
,
故答案为:
;
②VL该气体的质量为
×Mg,1L水的质量约为1000g,则溶液的质量为(
+1000)g,则形成的溶液中溶质的质量分数为:ω=
×100%=
×100%=
×100%%,
故答案为:
×100%%.

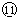 液态HCl
液态HCl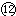 NaOH固体
NaOH固体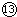 Na2SO4?10H2O
Na2SO4?10H2O 液态HCl不能导电,在水溶液中完全电离,是强电解质;
液态HCl不能导电,在水溶液中完全电离,是强电解质; NaOH固体不能导电,在水溶液中完全电离,是强电解质;
NaOH固体不能导电,在水溶液中完全电离,是强电解质; Na2SO4?10H2O不能导电,在水溶液中完全电离,是强电解质;
Na2SO4?10H2O不能导电,在水溶液中完全电离,是强电解质;
 ;属于非电解质的是②⑥⑩,
;属于非电解质的是②⑥⑩,
 ;②⑥⑩;
;②⑥⑩;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案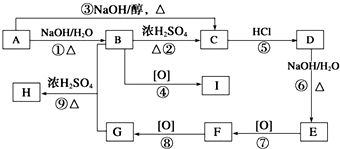
 C:CH3CH2OH
C:CH3CH2OH 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为: