
分析 (1)金属单质属于金属晶体;含有离子键的化合物属于离子晶体;分子间通过分子间作用力结合形成的晶体属于分子晶体;原子间通过共价键形成的空间网状结构的晶体属于原子晶体;
(2)分子晶体熔化时破坏分子间作用力;原子晶体熔化破坏共价键;熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答 解:(1)金属单质属于金属晶体,则Mg属于金属晶体;含有离子键的化合物属于离子晶体,所以BaCl2、Na2SO4属于离子晶体;分子间通过分子间作用力结合形成的晶体属于分子晶体,所以属于分子晶体的是干冰和碘片;原子间通过共价键形成的空间网状结构的晶体属于原子晶体,所以属于原子晶体的是金刚石、SiO2;
故答案为:③;①④;⑤⑥;②⑦;
(2)分子晶体熔化时破坏分子间作用力,所以熔化时不需要破坏化学键的是干冰和碘片;原子晶体熔化破坏共价键,则熔化破坏共价键的是金刚石和SiO2;熔点的一般规律:原子晶体>离子晶体>分子晶体,原子晶体的熔点最高,由于金刚石中C-C键的键能大于SiO2中Si-O键的键能,所以金刚石的熔点高于二氧化硅,所以金刚石的熔点最高,干冰常温下为气体,所以熔点最低的是干冰;
故答案为:⑤⑥;②⑦;②;⑤.
点评 本题考查的知识点较多,侧重考查学生对离子键、共价键、晶体类型的判断和熔点的比较等知识点,注意把握离子晶体、分子晶体、金属晶体、原子晶体的辨别.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
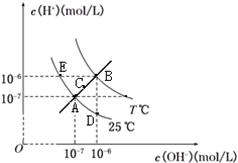
| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
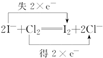 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:Fe2+、NO3-、SO42-、I- | |
| B. | 由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液中:Na+、I-、K+、NO3- | |
| D. | c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 18.4mol/L的硫酸溶液中含氢离子的数目为3.68NA | |
| B. | 若x g 中含NA个分子,则2x g中含2NA个分子 | |
| C. | 常温常压下,92gNO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 11g铵根离子[NH2T2]+中含中子数为4.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
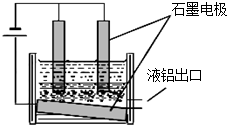 元素铝是在生产、生活中应用广泛的金属元素.
元素铝是在生产、生活中应用广泛的金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
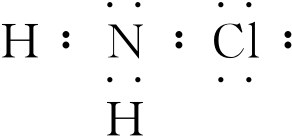 ,H2NCl中氯的化合价为+1价.
,H2NCl中氯的化合价为+1价.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4是一种新型化合物 | B. | N4和N2互为同素异形体 | ||
| C. | N4分子和N2一样含有N≡N | D. | N4中含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )| A. | 紫、红、蓝 | B. | 红、蓝、紫 | C. | 红、紫、蓝 | D. | 蓝、紫、红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com