
| A. | 25℃时,NH4Cl和NH3.H2O的混合液中离子浓度可能为C(NH4+)>C(Cl-)>C(OH-)>C(H+) | |
| B. | 向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 | |
| C. | 25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 | |
| D. | 25℃时,向稀氨水中通入NH3,溶液中C(OH-)减小 |
分析 A.若一水合氨少量,且溶液显示碱性时,可以满足c(NH4+)>c(Cl-)>c(OH-)>c(H+);
B.硫酸铜溶液浓度越小,铜离子的水解程度越大;
C.酸、碱溶液抑制了水的电离,醋酸钠促进了水的电离;
D.氨水浓度增大,溶液中氢氧根离子浓度增大.
解答 解:A.若混合液中一水合氨少量,且溶液显示碱性时,溶液中可以存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A正确;
B.向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液中氢离子浓度减小,则溶液酸性减弱,但是Cu2+水解程度增大,故B错误;
C.25℃时,pH=12的NaOH溶液、pH=2的硫酸都抑制了水的电离,而pH=12的CH3COONa溶液促进了水的电离,则三种溶液中水的电离程度不同,故C错误;
D.25℃时,向稀氨水中通入NH3,一水合氨浓度增大,一水合氨的电离程度减小,但溶液中c(OH-)增大,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、弱电解质的电离平衡及其影响为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析能力及灵活应用能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 | |
| D. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物②③⑥ | B. | 混合物①③④ | C. | 电解质②⑥ | D. | 非电解质④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
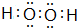 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中氨水中的c(OH-)与醋酸中的c(H+)相等 | |
| B. | CH3COONH4不发生分解 | |
| C. | 混合溶液中,c(NH3•H2O)=c(CH3COOH) | |
| D. | Kb(NH3•H2O)=3Ka(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com