
常温下,对pH=10的氨水而言,下列说法正确的是( )
|
| A. | 溶液中由水电离的氢离子浓度为10﹣4 |
|
| B. | 与pH=4的盐酸等体积混合后,c(Cl﹣)>c(NH4+) |
|
| C. | 通入一定量氨气后,依然存在c(NH4+)+c(H+)=c(OH﹣) |
|
| D. | 氨水中存在:c(NH3•H2O)>c(NH4+)>c(OH﹣)>c(H+) |
| 离子浓度大小的比较.. | |
| 分析: | A、对pH=10,溶液中的氢离子全部由水电离产生的,所以氢离子浓度为10﹣10; B、pH=4的盐酸等体积混合后溶液呈碱性,根据电荷守恒分析解答; C、电荷守恒分析解答; D、溶液中存在水的电离,所以氢氧根离子浓度大于铵根离子. |
| 解答: | 解:A、对pH=10的氨水而言,溶液中的氢离子全部由水电离产生的,所以氢离子浓度为10﹣10,故A错误; B、pH=4的盐酸等体积混合后溶液呈碱性,所以c(OH﹣)>c(H+),根据电荷守恒:c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),所以c(Cl﹣)<c(NH4+),故B错误; C、电荷守恒:c(NH4+)+c(H+)=c(OH﹣),故C正确; D、溶液中存在水的电离,所以氢氧根离子浓度大于铵根离子,所以离子浓度为:c(NH3•H2O)>c(OH﹣)>c(NH4+)>c(H+),故D错误; 故选C. |
| 点评: | 本题考查了水的电离及其影响因素和离子浓度大小的比较,题目难度中等,注意电荷守恒在解题中的应用. |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
英国《卫报》最近评出了“人类最糟糕的发明”,我们使用的塑料袋不幸获得这一殊荣,这是因为它对生态环境造成了严重污染,为了防治污染,有一条重要的途径是将合成高分子化合物重新变成小分子化合物,目前对结构简式为:
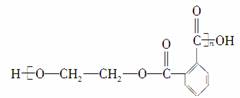 的物质已经成功地实现了这种处理,试分析若用CH3OH来处理它,能得到的有机物可能是( )
的物质已经成功地实现了这种处理,试分析若用CH3OH来处理它,能得到的有机物可能是( )
① 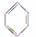 ②HOCH2CH2OH
②HOCH2CH2OH
③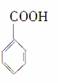 ④
④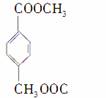
A.①④ B.②④ C.②③ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是
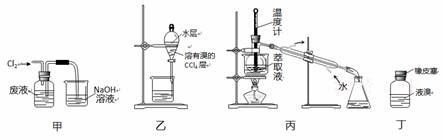
A.用装置甲氧化废液中的溴化氢 B.用装置乙分离油层和水层
C.用装置丙分离四氯化碳和液溴 D.用仪器丁密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下在密闭容器中加入NH4I发生反应:
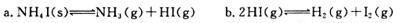
则反应a的平衡常数表达式为___________;达到平衡后,扩大容器体积,反应b的移动方向______________(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4 △H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
N2O4 △H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是_____________
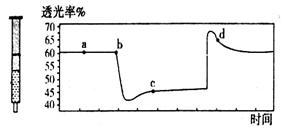
A.b点的操作是压缩注射器 B.c点与a点相比,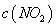 增大,
增大,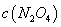 减小
减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
 D.d点:
D.d点: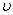 (正)>
(正)> 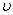 (逆)
(逆)
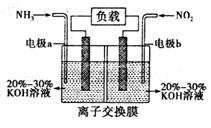
(3)利用反应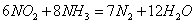 构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为______极,其电极反应式为________________
②当有2.24 L NO2(标准状况下)被处理时,转移电子为____________mol
③为使电池持续放电,该离子交换膜需选用_______(选填“阳”或“阴”)离子交换膜。
 (4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式______________________________。
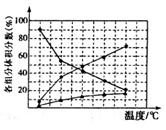
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有_______________________________________________ (任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如图1:
①该反应的热化学方程式为
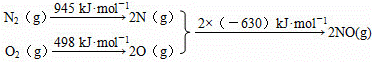 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol﹣1 .
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol﹣1 .
②根据图1所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K AC .
A.可能增大 B.一定不变 C.可能不变 D.可能减小 E.增大、减小、不变均有可能
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l)⇌H2O(g)+H2NCONH2(l)
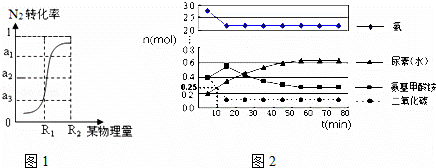
某实验小组模拟工业上合成尿素的条件,在一体积为500L的密闭容器中投入4mol氨和1mol二氧化碳,验测得
反应中各组分的物质的量随时间的变化如图2所示:
①合成尿素总反应的快慢由第 二 步反应决定.
②反应进行到10min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 1.5×10﹣4 mol/(L•min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:a. 氨基甲酸铵浓度先增大,15min后减小 ;b 15min时第一步反应达到平衡状态,55min第二步反应达到平衡状态 .
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮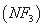 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.NF3在潮湿空气中泄漏会看到红棕色气体
C.每消耗0.2mol氧化剂,可收集到5.418L气体
D.若生成1molHNO3,则转移NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)= =2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于皂化反应的说法中,错误的是( )
A.油脂经皂化反应后,生成的高级脂肪酸钠、甘油和水形成混合液
B.加入食盐可以使肥皂析出,这一过程叫盐析
C.加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠
D.皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com