
【题目】某金属氯化物MCl2 27g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为___________,金属M的相对原子质量为___________。
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】C、H、N三种化学元素的质量分数共占人体化学成分的73%左右,而这三种元素在组成岩石圈的化学成分中,质量分数不到1%,这个事实说明
A. 生物界和非生物界具有统一性
B. 生物界与非生物界本质是不同的
C. 生物界没有一种元素是生物所特有的,生物和非生物从本质上看是相同的
D. 生物界和非生物界存在着本质的区别,两者还具有差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁合金是生活中常用的材料,下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+ 离子半径逐渐减小;化合物XN常温下为气体,据此回答:
(1)Z与M可形成常见固体化合物C,用电子式表示C的形成过程__________________ 。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:____________________________。
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________________________。
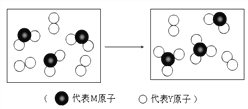
(4)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是____________ ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金有许多特点,如NaK合金为液体,而Na和K的单质均为固体。据此,试推测:生铁、纯铁、碳三种物质中,熔点最低的是( )
A.纯铁
B.生铁
C.碳
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2被称为“空中死神”,其对环境的危害常表现为_______________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于_______氧化物的性质。
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液,循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:

①此种方法中,可以循环利用的物质是_____________________________。
②写出反应Ⅰ的离子方程式:_____________________________________。
(3)SO2通过下列工艺流程可制备化工原料H2SO4和清洁能源H2

下列说法中正确的是____________ 。
A. 设备A中的溴水褪色,体现了SO2的漂白性
B. 该生产工艺的优点:Br2可以循环利用,并获得清洁能源H2
C. 该工艺流程的总反应方程式为:SO2+2H2O=H2SO4+H2
D. 设备B中物质分离操作为过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 mL的碱式滴定管中盛有溶液,液面恰好在20 mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A.5 mL
B.20 mL
C.大于5 mL
D.小于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
(1)MnO2熔融氧化应放在中加热(填仪器编号).①烧杯②瓷坩埚③蒸发皿④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒.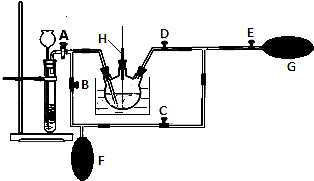
①为了能充分利用CO2 , 装置中使用了两个气囊.当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中.待气囊F收集到较多气体时,关闭旋塞 , 打开旋塞 , 轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中.然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应.
②检验K2MnO4歧化完全的实验操作是 .
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 , 自然冷却结晶,抽滤,得到针状的高锰酸钾晶体.本实验应采用低温烘干的方法来干燥产品,原因是 .
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:2MnO4﹣+5C2O42﹣+16H+=2Mn2++10CO2↑+8H2O现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00mL待测液,用0.1000molL﹣1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为(保留4位有效数字,已知M(KMnO4)=158gmol﹣1).若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将(填“偏大”、“偏小”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com