
分析 根据过程发生的化学反应:NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,Zn+2HCl═ZnCl2+H2↑,结合元素守恒以及物质之间的量的关系来计算回答.
解答 解:5.85g NaCl固体的物质的量是$\frac{5.85g}{58.5g/mol}$=0.1mol,过程发生的化学反应:NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HCl↑,MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,Zn+2HCl═ZnCl2+H2↑,得到关系式:,NaCl~HCl~0.5Cl2~HCl(和金属锌反应的)~0.5H2↑,最后可得H2的物质的量0.05mol,体积是0.05mol×22.4L/mol=1.12L,
答:最后可得H21.12L.
点评 本题考查学生有关化学方程式的计算知识,注意元素守恒思想的应用是关键,难度中等.


科目:高中化学 来源: 题型:填空题
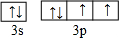 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.
维生素C又叫抗坏血酸,是一种水溶性维生素,在空气中及高温下易被氧化.碘单质能将其氧化,其结构如所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al、Si的金属性逐渐增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | HF、HCl、H2S、PH3的稳定性依次增强 | |
| D. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Mg+2HCl→MgCl2+H2↑+Q(Q>0)分别在20℃和50℃进行 | |
| B. | 颗粒大小同的铁和镁分别与0.1mol/L的硫酸反应 | |
| C. | 同浓度同体积的Na2S2O3溶液分别与同体积的0.1mol/L、0.2mol/L的稀硫酸反应 | |
| D. | 其他条件相同时,硫分别在氧气和空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 要提纯的物质 (少量杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙酸乙酯 (乙酸) | 苯 (苯酚) |
| (1)选用试剂 | ||||
| (2)分离方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com