
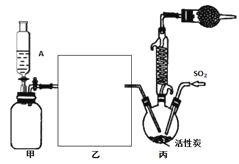
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,合成硫酰氯的实验装置如下图:
已知:①SO2(g)+Cl2(g)SO2Cl2(g) H=-97.3kJ/mol;
②硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内所缺装置为洗气瓶,瓶内应装的试剂是______________________。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______,分离产物的方法是(填字母)____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个简单实验验证二者是否恰好完全反应:__________(简要描述实验步骤、现象和结论)。仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
【答案】饱和食盐水 催化剂 浓硫酸 2ClSO3H![]() SO2Cl2+H2SO4 C ①②③ 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应
SO2Cl2+H2SO4 C ①②③ 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应
【解析】
根据装置图可知,装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂要将氯气压入后续反应装置,所以不能溶解氯气,应为饱和食盐水,硫酰氯易水解,所以生成的氯气要干燥,所以乙中应装有浓硫酸干燥氯气,氯气与二氧化硫反应需要用活性碳作催化剂,硫酰氯易水解易挥发,所以在三颈烧瓶上方应连接一个冷凝管和装有碱石灰的干燥管,则甲中活性炭的作用是催化剂。
(1)根据上面的分析可知,仪器A中盛放的试剂为饱和食盐水,装置丙中活性炭的作用是催化剂;
(2)根据上面的分析可知,在如图方框内画出所缺装置为浓硫酸干燥氯气的装置;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸,因此该反应的化学方程式为2ClSO3H![]() SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏;
SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏;
(4)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解,因此为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①先通冷凝水,再通气,②控制气流速率,宜慢不宜快,③若三颈烧瓶发烫,可适当降温,但不能加热三颈烧瓶,否则会加速分解;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色,检验方案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列实验方法中,正确的是
①在家庭中用食醋和碘化钾淀粉试纸检验食盐是否是加碘![]() 盐
盐
②用酒精从碘水中萃取碘
③用加热的方法从碘和沙子的混合物中分离出碘
④实验室制![]() 、
、![]() 都用同一套装置
都用同一套装置
⑤用淀粉溶液直接检验![]()
⑥根据加入![]() 溶液产生白色沉淀的现象认定溶液中含
溶液产生白色沉淀的现象认定溶液中含![]()
⑦盛放液溴的试剂瓶内放少量蒸馏水防止液溴的挥发
⑧用溴水鉴别![]() 和
和![]()
A.①②③⑧B.③④⑥⑦C.①③⑦⑧D.②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是
A.![]() 和
和![]() 是等电子体,键角均为
是等电子体,键角均为![]()
B.![]() 和
和![]() 是等电子体,均为平面正三角形结构
是等电子体,均为平面正三角形结构
C.![]() 和
和![]() 是等电子体,均为三角锥形结构
是等电子体,均为三角锥形结构
D.![]() 和苯是等电子体,
和苯是等电子体,![]() 分子中不存在“肩并肩”式重叠的轨道
分子中不存在“肩并肩”式重叠的轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
![]()
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各式中能正确表示水解反应的是
A.S2-+2H2O![]() H2S+2OH-B.NH4++H2O
H2S+2OH-B.NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
C.AlO2-+ HCO3-+H2O==Al(OH)3↓+ CO32-D.HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸溶液的pH=6,乙酸溶液的pH=2,则下列叙述正确的是
A.甲、乙两溶液的c(H+)之比为400∶1
B.甲、乙两溶液均呈酸性
C.甲中水的电离程度大于乙中水的电离程度
D.甲、乙两溶液等体积混合后溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种有机物的球棍模型如图(图中棍表示单键、双键或三键)。关于该有机物的说法正确的是
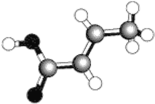
A.该球棍模型表示的化学式为C6H6
B.该有机物只能发生取代反应和加成反应两种反应
C.该有机物可使溴水褪色,但不能使酸性高锰酸钾溶液褪色
D.该有机物不是乙酸的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可在高纯度氨气下,通过球磨氢化锂的方式合成高纯度的储氢材料氨基锂,该过程中发生反应:LiH(s)+NH3(g)=LiNH2(s)+H2 (g)。如图表示在0.3 MPa下,不同球磨时间的目标产物LiNH2的相对纯度变化曲线。下列说法正确的是 ( )
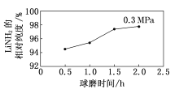
A.工业生产中,在0.3 MPa下合成LiNH2的最佳球磨时间是2.0 h
B.投入定量的反应物,平衡时混合气体的平均摩尔质量越大,LiNH2的相对纯度越高
C.在0.3 MPa下,若平衡时H2的物质的量分数为60%,则该反应的平衡常数K=1.5
D.LiH和LiNH2都能在水溶液中稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____,直到因加入一滴盐酸后,溶液由______色变为____色,并____为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,所用盐酸溶液的体积为_____mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 25.31 | 25.09 |
依据表中数据列式计算该NaOH溶液的物质的量浓度_____(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com