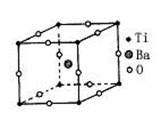
(12分)几何学是解决物质结构问题的基础。C
60(每个碳原子与周围3个碳原子相连,如下图)是一系列碳原子簇合物(即富勒烯)的一个典型代表,它的应用十分广泛,涉及光学、信息学、药物学、催化、储氢、超导等。就其结构而言也很特殊。18世纪俄罗斯数学家莱昂哈德·欧拉通过理论论证,明确指出任何一个这样的多面体都必须恰好具有12个五边形方能闭合成多面体。试回答:
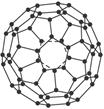
(1)由12个五边形构成的最小碳笼的化学式为__________________________________,计算过程为_________________________。
(2)除碳原子能形成笼形球状分子外,实验中还发现了以金属原子部分取代碳原子的“金属——碳原子”团簇分子,即金属碳烯,若金属碳烯的价电子总数与碳原子团簇分子的价电子总数相等,你认为能代替碳原子的金属有____________________________________(填在周期表中的位置)。
(3)在最小的金属碳烯原子簇化合物中,金属与碳原子个数比为2∶3,这种最小金属碳烯团簇分子的化学式为_____________________________(用M代金属)。
(4)计算机技术的发展带动了理论化学的发展。最近,美国研究人员通过理论计算证明,可以用24个X原子和24个Y原子代替48个碳原子形成C
12X
24Y
24新的团簇分子。若已知这种全非金属团簇分子与C
60价电子总数相等,且X、Y、C元素位于同一周期,X的原子半径小于Y的原子半径,则在12个五边形中,每个五边形中有___________个X原子,有___________个Y原子,X是___________元素,Y是___________元素。
(5)目前,化学家已经找到十余种富勒烯家族成员,如C
28、C
32、C
50、C
60、C
70……(富勒烯家族成员还在增加),它们的分子结构都是由正五边形和正六边形构成的封闭的凸多面体,则C
80结构中五边形和六边形的个数分别是_________和_________。
(6)下列物质不属于富勒烯家族的有___________。
(7)晶体硼的基本结构单元是由硼原子组成的正二十面体(如下图所示)。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。请根据观察和计算确定:
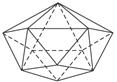
①该基本结构单元内,所含硼原子的个数为__________;所含B—B键的数目是__________。
②若将晶体硼结构单元的每个顶角削去,余下部分就和C
60晶体的结构相同。据此确定,C
60是由__________个正六边形和__________个正五边形构成。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案