
��д��OA��AB��C��CD�Ķη�����Ӧ�Ļ�ѧ����ʽ��
�Ƽ���A��B��C��D��������Ba(OH)2��Һ��������������������������±���
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(����)/g |
|
|
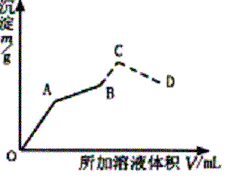
| ��OA�η�ӦΪ��2KAl(SO4)2+3Ba(OH)2=3BaSO4��+2Al(OH)3��+K2SO4
AB�η�ӦΪ��KAl(SO4)2+ 2Ba(OH)2==KAlO2+2BaSO4��+2H2O BC�η�ӦΪ��KAlO2+HCl+H2O=Al(OH)3��+KCl CD�η�ӦΪ��Al(OH)3+3HCl=AlCl3+3H2O ��A��ʱ���� 2KAl(SO4)2 �� 3Ba(OH)2 �� 3BaSO4 �� 2 Al(OH)3 2 3 3 2 0.2��0.05
VA��0.1 ��VA = �ó���mA= B��ʱ�У� KAl(SO4)2 �� 2Ba(OH)2 �� 2BaSO4 1 2 2 0.2��0.05 0.1VB 2��0.2��0.05 VB=0.2 L�� ��200 mL Ba(OH)2��Һ mB=0.1��0.2��233=4.66g
|



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | ���� |
| ������ʢ��30mL 0.2mol?L-1KI��Һ����ƿ�����ε��뼸�ε�����Һ������ϡ���ᣬ���õζ�����μ���KBrO3��Һ | ����KBrO3��Һ���룬��Һ����ɫ��Ϊ��ɫ��������ձ��ֲ��� |
| ����������������Һ�е���KBrO3��Һ | ��Һ����ɫ����ȥ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�022
��ͼΪ��ʢ��0.2 mol•L-1 50 mL������Һ�У���������0.1 mol•L-1 Ba(OH)2��Һ�����ɳ������������ż���Ba(OH)2��Һ������仯��ͼ�������ij��������ʱ����B�㣩�ļ�0.5 mol•L-1 HCl.�����������ַ����仯�����߲��֣���

��д��OA��AB��C��CD�Ķη�����Ӧ�Ļ�ѧ����ʽ��
�Ƽ���A��B��C��D��������Ba(OH)2��Һ��������������������������±���
|
|
A |
B |
|
V[Ba(OH)2]/mL |
|
|
|
m(����)/g |
|
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com