
【题目】下列实验中的颜色变化,与氧化还原反应无关的是

A.AB.BC.CD.D
【答案】B
【解析】
A.Ag+与Cl-结合形成氯化银沉淀,消耗氯水中的Cl-,导致Cl-浓度较低,促使氯气与水反应向正向进行产生氯离子,氯水中氯气含量减少,淡黄绿色逐渐褪去,氯气和水反应为氧化还原反应,故A与氧化还原反应有关;
B.向氯化铁溶液中加入氢氧化镁沉淀,氢氧化镁沉淀转化为更难溶的氢氧化铁沉淀,白色浑浊转变为红褐色沉淀,属于沉淀的转化,没有化合价的变化,没有发生氧化还原反应,故B与氧化还原反应无关;
C.草酸是较好的还原剂,很容易被高锰酸钾在酸性条件下氧化生成二氧化碳,方程式为:5H2C2O4+2MnO4-+6H+ = 2Mn2++10CO2↑+8H2O,现象是高锰酸钾褪色并有气泡产生,锰元素的化合价从+7降低到+2价,有化合价的变化,故C与氧化还原反应有关;
D.钠在高温下与空气中的氧气反应并燃烧,钠元素的焰色反应为黄色,则反应中产生黄色火焰,并生成淡黄色过氧化钠,氧元素的化合价从0降低到-1价,有化合价的变化,故D与氧化还原反应有关;
答案选B。


科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g) ![]() COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
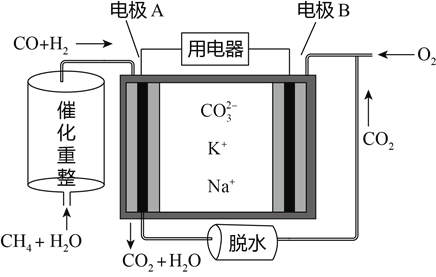
A. 电极A上H2和CO都发生了氧化反应
B. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
C. 电池工作时,电能转变为化学能
D. 电极B上发生的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化碳结构如图,其中 β—氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是
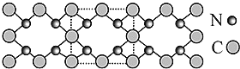
A. 氮化碳属于原子晶体
B. 氮化碳中 C 为-4 价,N 为+3 价
C. 氮化碳的化学式为 C3N4
D. 晶体中原子最外层都达 8 电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
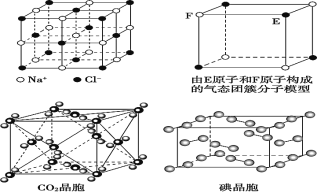
A. 在 NaCl 晶体中,Na+或 Cl-的配位数都是 6
B. 该气态团簇分子的分子式为 EF 或 FE
C. 在 CO2 晶体中,一个晶胞实际含有 4 个 CO2 分子
D. 在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E的原子序数依次增大,且均小于36。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;D的价电子数为2且与E同周期;E的基态原子的内部各能层均排满,且4s能级有1个单电子。回答下列问题:
(1)基态E原子的价电子排布式为____________________
(2)A、B、C三种元素第一电离能由大到小的顺序为___________(用元素符号表示)。
(3)与A的单质分子互为等电子体的分子和离子分别是________(用分子和离子符号表示)。AB2的空间构型为___________,其中A原子的杂化类型是_______________
(4)B元素简单氢化物的沸点是同族元素中最高的,原因是_____________
(5)向含E元素的硫酸盐溶液中加入过量氨水,可得到深蓝色透明溶液。向溶液中加人乙醇,将析出深蓝色晶体。该晶体的化学式为[Cu(NH3)4]SO4H2O晶体中阳离子的结构式为____________
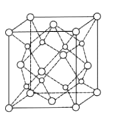
(6)C和D形成化合物的晶胞结构如图所示,已知晶体的密度为ρg/cm,阿伏加德罗常数为NA,则晶胞边长a=______________cm(用含ρ、NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
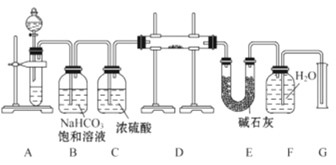
回答下列问题:
(1)装置A中液体试剂选用________
(2)装置B的作用是_________________,装置C的作用是_____________,装置E中碱石灰的作用是______________________________________________。
(3)装置D中发生反应的化学方程式是_________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com