
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子数目为0.6NA | |
| C. | 标准状况下,2.24LCH3CH2OH含有共价键数为0.8NA | |
| D. | 12.5mL 16 mol•L-1浓硫酸与6.5g锌共热,转移的电子数等于0.2NA |
分析 A、1 mol FeI2中含1mol亚铁离子和2mol碘离子;
B、氮气与氢气反应是可逆反应不可能完全转化;
C、标准状况下CH3CH2OH是液体,所以气体摩尔体积不适用;
D、锌与浓硫酸和稀硫酸反应都生成硫酸锌,生成1mol锌转移2mol电子.
解答 解:A、1 mol FeI2中含1mol亚铁离子和2mol碘离子,均能被氯气氧化为铁离子和碘单质,故1mol1 mol FeI2失去3mol电子,即3NA个,故A错误;
B、氮气与氢气反应是可逆反应不可能完全转化,所以0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子数目小于0.6NA,故B错误;
C、标准状况下CH3CH2OH是液体,所以气体摩尔体积不适用,故C错误;
D.12.5mL16mol/L浓硫酸,硫酸的物质的量为0.0125mL×16mol/L=0.2mol,6.5g锌物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,依据Zn~2H2SO4(浓),Zn~H2SO4(稀),可知锌完全反应生成0.1mol锌离子,转移电子数等于0.2NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,熟悉浓硫酸的性质,掌握以物质的量为核心的计算公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol CO2通入足量NaOH溶液,则溶液中阴离子数目为0.1 NA | |
| B. | 标准状况下,将11.2 L的Cl2通入足量的NaOH溶液中,转移的电子数为NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 | |
| B. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 | |
| C. | 铝和NaOH溶液反应:Al+2OH-═Al-+2H2↑ | |
| D. | 纯铝比铝合金的硬度更大、熔点更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
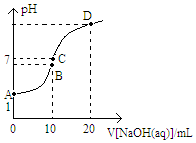 常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )
常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )| A. | 水电离出来的c(OH-):D点>B点 | |
| B. | C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+) | |
| C. | B点:c(HX-)>c(H+)>c(X2-)>c(H2X) | |
| D. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}X)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的大小关系是c(Na+)>c(CO32-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O═HCO3-+Cl-+HClO | |
| C. | 向0.1mol•L-1 HClO溶液中滴加NaOH溶液至c(HClO):c(ClO-)=1:3,此时溶液pH=8 | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g分子式为CnH2n的烃中含有的C-H键的数目一定为2NA | |
| B. | 1mol Fe与水蒸气反应生成的氢气为22.4L | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| D. | 0.1mol H2S分子中含氢离子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0032mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)<v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率大于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,ZX与水反应放出的气体的化学式为H2.
,ZX与水反应放出的气体的化学式为H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com