
(14+2分)已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大。X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子。请回答下列问题。
(1)微粒 的中心原子杂化类型为 ,化合物YW3的空间构型为 。
的中心原子杂化类型为 ,化合物YW3的空间构型为 。
(2)R基态原子的电子排布式为 。
(3)一种新型超导晶体的晶胞如图所示,则该晶体的化学式为 ,
其中一个Q原子紧邻 个R原子。

(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是 。弱酸HXY分子中存在的σ键与π键的数目之比为 。
(1)sp2 三角锥形 (2)1s22s22p63s23p63d84s2 或[Ar]3d84s2 (3)MgNi3C 12
(4)Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH- 1:1
【解析】
试题分析:元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大。X基态原子的核外电子分布在3个能级,且各能级电子数相等,因此X是碳元素;Z是地壳中含量最多的元素,则Z是氧元素,所以是氮元素;W是电负性最大的元素,则W是氟元素;元素Q的核电荷数等于Y、W原子的最外层电子数之和,即Q的原子序数是5+7=12,则Q是Mg。R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,则R是Ni元素。
(1)微粒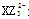 是碳酸根离子,碳原子的价层电子对数=3,且无孤对电子,所以中心原子杂化类型为sp2杂化;化合物YW3是NF3,氮原子的价层电子对数=3+
是碳酸根离子,碳原子的价层电子对数=3,且无孤对电子,所以中心原子杂化类型为sp2杂化;化合物YW3是NF3,氮原子的价层电子对数=3+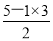 =4,含有一对孤对电子,所以空间构型为三角锥形。
=4,含有一对孤对电子,所以空间构型为三角锥形。
(2)根据核外电子排布规律可知基态Ni原子的电子排布式为1s22s22p63s23p63d84s2 或[Ar]3d84s2。
(3)根据晶胞的结构可知,晶胞中含有一个碳原子,Mg原子个数=8×1/8=1个,Ni原子个数=6×1/2=3个,则该晶体的化学式为MgNi3C,镁原子位于顶点处,镍位于面心处,则其中一个Q原子紧邻12个R原子。
(4)Ni的氢氧化物能溶于含CN-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-;弱酸HXY分子的结构式为H-C≡N,由于单键都是σ键,而三键是由1个σ键和2个π键构成,则分子中存在的σ键与π键的数目之比为1:1。
考点:考查元素推断、核外电子排布、杂化轨道、空间构型、共价键以及晶胞结构等


科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列溶液一定呈酸性的是
A.c(OH-)<c(H+)的溶液 B.含有较多H+的溶液
C.pH<7的溶液 D.能与金属Al反应放出H2的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:实验题
(本题共12分)下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。

有关数据列表如下:

请完成下列填空:
36.A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:__________________。
37.气体发生装置使用连通滴液漏斗的原因_________________________________________。
38.请写出C装置中的离子反应方程式_______________________________________。
39.装置D中品红溶液的作用是__________________________________;
40.反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是___________________________________________。
41.学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是___________________。
42.有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是__________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ | 表述Ⅱ | |
A | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
B | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
C | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
D | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
物质的熔沸点能用键能大小解释的是
A.H2O>H2S B.N2>O2 C.Na>K D.SiO2>CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三12月月考理综化学试卷(解析版) 题型:选择题
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
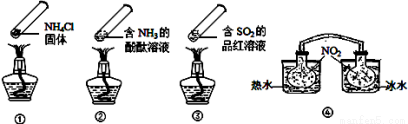
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
元素A和B的原子序数都小于18,已知A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个。则A、B两种元素形成化合物的性质可能
A.能与水反应 B.能与硫酸反应
C.能与氢氧化钠反应 D.能与碳酸钠反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
某温度下,可逆反应mA(g)+nB(g) pC(g)的平衡常数为K,下列对K的说法正确的是
pC(g)的平衡常数为K,下列对K的说法正确的是
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
B.铅蓄电池放电时铅电极发生氧化反应
C.胶体与溶液的分离可用渗析的方法
D.生铁浸泡在食盐水中发生析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com