
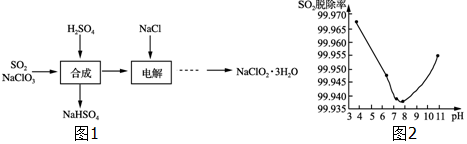
分析 由制备流程可知,NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2,然后电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2,最后NaClO2溶液结晶、干燥得到产品,以此来解答.
解答 解:(1)“反应”步骤中生成ClO2的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
故答案为:2NaClO3+SO2+H2SO4═2NaHSO4+2ClO2;
(2)由分析可知,阳极Cl-失电子生成Cl2;
故答案为:Cl2;
(3)碱性条件下OH-吸收SO2,与ClO2反应的SO2增多,SO2脱除率又升高;
故答案为:碱性条件下OH-吸收SO2;
(4)n(Na2S2O3)=2.00mol•L-1×22×10-3L=4.4×10-2mol
NaClO2 …4Na2S2O3
1 4
n(NaClO2) 4.4×10-2mol
n(NaClO2)=1.1×10-2mol(1分)
ω(NaClO2)=$\frac{1.1×10-2mol×90.5g•mol-1}{1g}$×100%=99.55%
产品达到化学纯度;
答:该样品达到化学纯试剂纯度.
点评 本题考查了物质制备的实验方法分析、氧化还原反应、电解池的原理、物质含量的有关计算等,注意物质性质的理解应用,题目难度中等.


科目:高中化学 来源: 题型:实验题
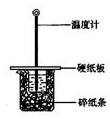 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时左码右物 | |
| C. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再滴加几滴水至刻度线 | |
| D. | 在容量瓶中进行定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只根据反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,不能判断出该反应△H的正负 | |
| B. | 对于反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),加入更多的催化剂会使平衡向正反应方向移动 | |
| C. | 向纯水中加入盐酸能使水的电离平衡逆向移动,但水的离子积不变 | |
| D. | 用惰性电极电解1 L 1 mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 mol Cu(OH)2固体可将溶液恢复至原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸(HCOOH)与正丁醇 | B. | 乙酸与甲醇(CH3OH) | ||
| C. | 乙醇与CH3CH2COOH | D. | CH3CH2COOH与甲醇(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
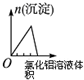
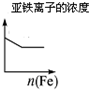
| 将二氧化硫通入到一定量氯水中 | 将氯化铝溶液滴入到一定量NaOH溶液中 | NaOH溶液加入AlCl3、Mg(NO3)2、HNO3溶液 | 将铁粉加入到一 定量氯化铁溶液中 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com