
| A、向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠和氧气反应,条件不同,产物不同 |
| B、钠长期置于空气中,表面不能形成致密氧化膜 |
| C、钠与水反应时,钠熔成小球在水面四处游动 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
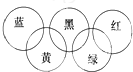 奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| 蓝 | 黄 | 黑 | 绿 | 红 | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、硫酸铵溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、CO2通入过量氢氧化钠溶液中 CO2+2OH-═CO32-+H2O |
| D、CuO与盐酸反应:CuO+2H+═Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
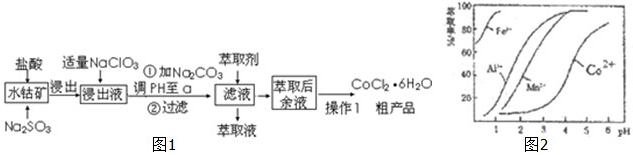
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com