
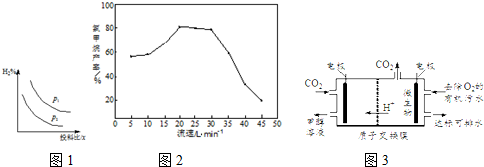
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;投料比相同时,增大压强平衡正向移动,氢气的含量越小;
(2)根据盖斯定律书写氯化铵和甲醇的热化学方程式;如果△G=△H-T△S<0,该反应就能自发进行;
流速过高反应物与催化剂的接触时间过短,原料利用率降低;
加入水蒸气能抑制主副反应的发生;
(3)根据氢离子移动方向知,左边装置为阴极,二氧化碳得电子和氢离子反应生成甲醇和水.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$;投料比相同时,增大压强平衡正向移动,氢气的含量越小,根据图知,p1<p2,
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO).{c}^{2}({H}_{2})}$;<;
(2)将两个方程式相加得NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132 kJ•mol-1;如果△G=△H-T△S<0,该反应就能自发进行,该反应的△S>0,导致其△G可能小于0,能自发进行;
流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低;
加入水蒸气能抑制主副反应的发生,所以对主副反应有抑制作用,提高CH3Cl纯度的同时,也降低了其产率;
故答案为:NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132 kJ•mol-1;△S>0;
流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低;对主副反应有抑制作用,提高CH3Cl纯度的同时,也降低了其产率;
(3)根据氢离子移动方向知,左边装置为阴极,二氧化碳得电子和氢离子反应生成甲醇和水,电极反应式为CO2+6H++6e-=CH3OH+H2O,
故答案为:CO2+6H++6e-=CH3OH+H2O.
点评 本题考查化学平衡计算、电解原理、盖斯定律等知识点,为高频考点,侧重考查学生分析计算及识图能力,水对学生综合能力的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的自发过程都是熵值减小的过程 | |
| B. | 吸热的自发过程常常是熵值增加的过程 | |
| C. | 水自发地从高处流向低处,是趋向能量最低状态的倾向 | |
| D. | 只根据焓变来判断化学反应的方向是可以的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO- | |
| B. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| C. | NaHCO3溶液中HCO3-的水解:HCO3-+H2 O?H3 O ++CO32- | |
| D. | 将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32?+3 H2 O═2Fe(OH)3↓+3 CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应,起始时二者产生氢气的速率基本相等 | |
| B. | 100mL 1mol/L的盐酸和50mL 2mol/L的盐酸分别与足量的锌反应,二者放出氢气的速率和质量均相等 | |
| C. | 100mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等 | |
| D. | 100mL 0.1mol/L的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量与后者相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=+488.3 kJ•mol-1 | B. | △H=-244.15 kJ•mol-1 | ||
| C. | △H=-977.6 kJ•mol-1 | D. | △H=-488.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中X物质为O2 | |
| B. | 反应物Na2O2只做氧化剂 | |
| C. | 该反应中发生氧化反应的过程只有FeSO4→Na2FeO4 | |
| D. | 每生成lmol Na2FeO4,反应过程中转移4 mol e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com