
下列有机物的名称肯定错误的是( )
A.2甲基1丁烯 B.2,2二甲基丙烷
C.5,5二甲基3己烯 D.4甲基2戊炔
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
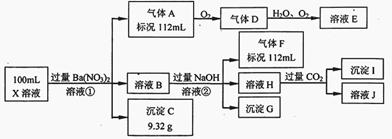
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中操作或现象能达到预期实验目的的是 ( )
| 选项 | 实验目的 | 操作或现象 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| D | 证明溶液中存在平衡: Fe3++3SCN-Fe(SCN)3 | 将1 mL KSCN溶液与1 mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
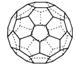 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
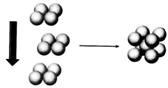 (4)X元素对应的单质在形成晶体时,采用如图2所示
(4)X元素对应的单质在形成晶体时,采用如图2所示
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的结构简式。

查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,发出苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)写出一种工业制备单质F的化学方程式:____________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为___________, 请用离子方程式解释该溶液呈碱性的原因____________________________________________;
(3)实验室用F从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
|
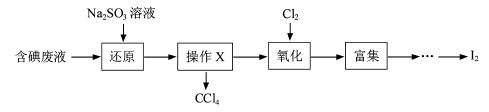
①向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为__________ ;
②操作X的名称为___________________。
③已知:5SO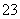 +2IO
+2IO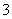 +2H+===I2+5SO
+2H+===I2+5SO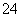 +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO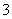 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO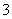 的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验没有碘单质存在;___________________________________;
另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO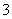 ;若溶液不变蓝,说明废水中不含有IO
;若溶液不变蓝,说明废水中不含有IO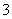 。
。
(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
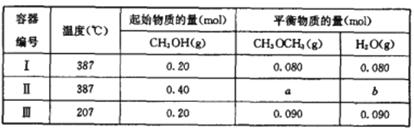
(1) 该反应的化学平衡常数表达式为K=__________.
(2) 该反应的正反应为___________(填“放热”或“吸热”)反应。
(3) 容器I中的反应达到平衡时所需的时间____________(填“大于”“小于”或等于)容器II中的。
(4)a= b=
(5)已知下面两个反应(m、n.均大于0):
反应①:CO(g)+2H2(g) ⇌ CH3OH(g) ΔH=-m kJ·mol-1
反应②2 CO(g)+4 H2(g) ⇌ CH3OCH3(g)+H2O(g) ΔH=-n kJ·mol-1
则下列m与n的关系中,正确的是 (填字母)。
A. n﹥2m B. m ﹥2 n C. n﹥m D. m﹥3n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com