
【题目】用甲苯合成某保湿香料E的流醒如下:

已知:在稀碱溶液中,若环上的卤素原子不易发生取代
(1)上述流程中属于取代反应的步骤有_______________。
(2)上述流程中加人的试剂:②是________、③是_______、④是________。
(3)B的结构简式是_______________。
(4)下列有关D的叙述正确的是_______(填字母)
A.有两种官能团,是羟基和羧基
B.能在Cu催化剂、加热条件下发生氧化反应
C.可以形成高分子化合物
D.与浓溴水反应产生白色沉淀
【答案】 ①④⑤ 酸性KMnO4溶液 H2 NaOH水溶液、稀盐酸  ABC
ABC
【解析】根据E的结构简式可知,甲苯与溴发生取代反应生成A为三溴甲苯 ,
, 被酸性高锰酸钾溶液氧化生成B为
被酸性高锰酸钾溶液氧化生成B为 ,
, 与氢气发生加成反应生成C为
与氢气发生加成反应生成C为 ,
, 在氢氧化钠的水溶液中加热发生水解反应后酸化生成D为
在氢氧化钠的水溶液中加热发生水解反应后酸化生成D为 ,
, 与乙醇发生酯反应反应生成E。(1)上述流程中①属于取代反应、②属于氧化反应、③属于加成反应或还原反应、④属于取代反应、⑤属于酯化反应或取代反应。故属于取代反应的步骤有①④⑤;(2)上述流程中加入的试剂:②是酸性KMnO4溶液、③是H2、④是NaOH水溶液、稀盐酸;(3)B的结构简式是
与乙醇发生酯反应反应生成E。(1)上述流程中①属于取代反应、②属于氧化反应、③属于加成反应或还原反应、④属于取代反应、⑤属于酯化反应或取代反应。故属于取代反应的步骤有①④⑤;(2)上述流程中加入的试剂:②是酸性KMnO4溶液、③是H2、④是NaOH水溶液、稀盐酸;(3)B的结构简式是 ;(4) D为
;(4) D为 ,A.有两种官能团,是羟基和羧基,选项A正确;B.含有醇羟基,能在Cu催化剂、加热条件下发生氧化反应,选项B正确;C.可以发生缩聚反应形成高分子化合物,选项C正确;D.没有酚的结构,不能与浓溴水反应产生白色沉淀,选项D错误。答案选ABC。
,A.有两种官能团,是羟基和羧基,选项A正确;B.含有醇羟基,能在Cu催化剂、加热条件下发生氧化反应,选项B正确;C.可以发生缩聚反应形成高分子化合物,选项C正确;D.没有酚的结构,不能与浓溴水反应产生白色沉淀,选项D错误。答案选ABC。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式 。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
③NaH2PO2为 (填“正盐”或“酸式盐”)
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
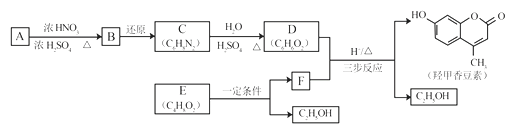
已知: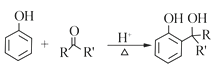
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是__________________。B中所含的官能团是_____________。
(2)C→D的反应类型是___________________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
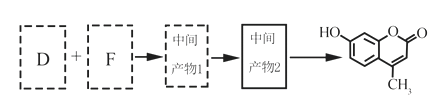 D:______________、F:______________、中间产物1:______________、中间产物2:______________
D:______________、F:______________、中间产物1:______________、中间产物2:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C. 氢气和碘蒸气反应达平衡后加压颜色加深
D. 硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
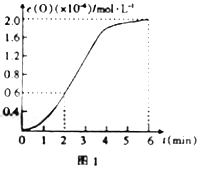
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
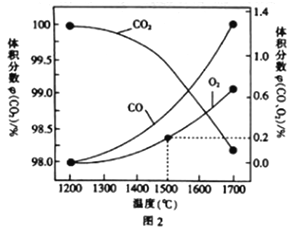
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
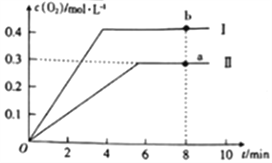
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示。
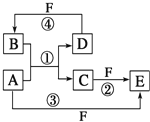
(1)若 A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数 A 是 D 的 2 倍,所含元素的原子最外层电子数 D 是 A 的 2 倍,F 的浓溶液与 A、D 反应都有红棕色气体生成。请写出以下物 质的化学式:B_____F_____;反应④的化学方程式为_____.
(2)若 A 是常见的变价金属的单质,D、F 是气态单质,且反应①在水溶液中进行。反应②也在水溶液 中进行,其离子方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com