

| 杂质 | 加入试剂 | 化学方程式 |
| Na2SO4 | ||
| MgCl2 | ||
| CaCl2 | ||
| - | - | - |
| 杂质 | 加入试剂 | 化学方程式 |
| Na2SO4 | BaCl2溶液 | BaCl2+Na2SO4=BaSO4↓+2NaCl |
| MgCl2 | NaOH溶液 | MgCl2+2NaOH=2NaCl+Mg(OH)2↓ |
| CaCl2 | Na2CO3溶液 | CaCl2+Na2CO3=BaCO3↓+2NaCl |
| - | - | - |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
 (1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无双键、无支链的链烃的结构简式
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无双键、无支链的链烃的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
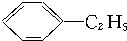 )的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
)的方法中,原子经济性最好的是(反应均在一定条件下进行)( )A、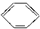 +C2H5Cl→ +C2H5Cl→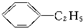 +HCl +HCl |
B、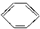 +C2H5OH→ +C2H5OH→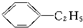 +H2O +H2O |
C、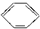 +CH2═CH2→ +CH2═CH2→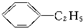 |
D、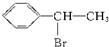 → →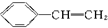 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | Cl- OH- NO3- CO32- X |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 体积 | ||||
| 反应温度/℃ | 0.1mol?L-1Na2S2O3 | 0.1mol?L-1H2SO4 | H2O | |
| A | 10 | 10 | 10 | 0 |
| B | 10 | 9 | 10 | V1 |
| C | 50 | 8 | 10 | V2 |
| 实验步骤 | 预期现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
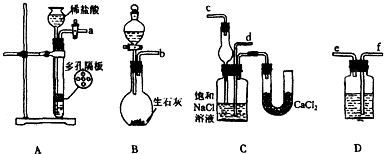
查看答案和解析>>
科目:高中化学 来源: 题型:
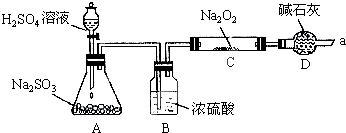
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com