
| A. | 已知常温下AgCl的溶解度远大于AgBr,现将AgCl和AgBr的两种饱和溶液等体积混合后,再加入足量浓AgNO3溶液,生成的AgCl沉淀多于AgBr沉淀 | |
| B. | Fe(OH)3溶于氢碘酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 甲基橙呈黄色的溶液中,I-、Cl-、NO3-、Na+一定可以大量共存 | |
| D. | 已知甲烷的燃烧热为890.3kJ•mol-1,则表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
分析 A、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl;
B、三价铁与碘离子发生氧化还原反应;
C、甲基橙呈黄色,溶液可能显酸性,NO3-氧化I-;
D、H2O(g)是气态,不是稳定的氧化物.
解答 解:A、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl,故A正确;
B、漏掉了三价铁与碘离子发生的氧化还原反应,故B错误;
C、甲基橙呈黄色,溶液可能显酸性,NO3-氧化I-,故C错误;
D、H2O(g)是气态,不是稳定的氧化物,故D错误,
故选A.
点评 本题主要考查的是离子共存、燃烧热、溶解度大小关系的应用、离子方程式等,难度不大.


科目:高中化学 来源: 题型:解答题
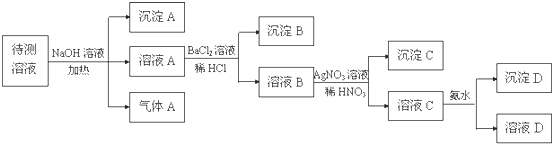
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,都表现为热量的变化 | |
| B. | 熔融态导电的一定是离子化合物 | |
| C. | 构成单质分子的微粒中一定含有化学键 | |
| D. | 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. |  | B. |  | C. |  | D. | 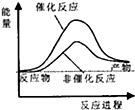 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
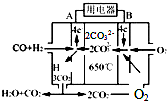 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | Se氧化物化学式有:SeO2、SeO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定存在离子键,可能存在共价键 | |
| B. | 由金属元素和非金属元素组成的化学键一定是共价键 | |
| C. | 非极性键只存在于双原子单质分子中 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
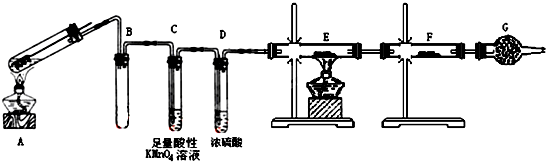
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g氨气中所含原子数为NA | |
| B. | 标准状况下,1 L水中所含分子数为$\frac{1}{22.4}$NA | |
| C. | 0.3 mol/L的MgCl2溶液中含Mg2+数目0.3 NA | |
| D. | 常温常压下,16 g O2含有的氧原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com