
【题目】在恒温条件下,欲使CH3COONa的稀溶液中c(CH3COO-)/c(Na+)比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A. 只有②⑤ B. 只有①②⑤
C. 只有①② D. 只有②④⑤
【答案】D
【解析】加入固体NaOH,溶液中c(Na+)明显增大,虽然氢氧根离子会抑制醋酸根离子的水解,但是c(CH3COO-)的增大一定不明显,所以c(CH3COO-)/c(Na+)比值减小,①错误。加入固体KOH,氢氧根离子会抑制CH3COONa的水解,c(CH3COO-)增大,c(CH3COO-)/c(Na+)比值增大,②正确。加入固体NaHSO4,溶液中c(Na+)明显增大,同时电离出的氢离子会促进CH3COONa的水解,c(CH3COO-)减小,c(CH3COO-)/c(Na+)比值减小,③错误。加入固体CH3COONa,增大了溶液中的CH3COONa浓度,浓度越大CH3COONa的水解成都越小,所以c(CH3COO-)/c(Na+)比值越大,④正确。加入冰醋酸,醋酸电离会增大c(CH3COO-),c(CH3COO-)/c(Na+)比值增大,⑤正确。所以正确的是②④⑤,选项D正确。
【题型】单选题
【结束】
16
【题目】40℃时,在氨—水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是( )
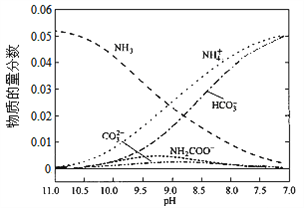
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成
D. 随着CO2的通入,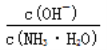 不断增大
不断增大
【答案】D
【解析】从图中在pH=9的点,做一条垂线就可以大致判断其浓度,所以有c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),选项A正确。c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)是溶液的电荷守恒,所以是任何pH下都成立的。选项B正确。随着pH的降低,NH2COOˉ的浓度增大,说明生成了含有NH2COOˉ的化合物,后期NH2COOˉ的浓度又减小,说明该化合物又被反应,说明含有NH2COOˉ的化合物是中间产物,选项C正确。根据一水合氨的电离平衡常数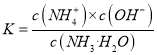 ,得到
,得到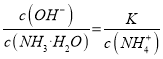 ,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以
,因为通入二氧化碳实际就是加入碳酸,加入酸c(NH4+)一定增大,所以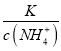 减小,即
减小,即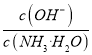 减小,选项D错误。
减小,选项D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
(1)该反应的还原剂是________,还原产物是________。
(2)该反应中氧化剂与氧化产物的物质的量之比是________。
(3)当有2 mol HNO3参加反应时,被氧化的物质是________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于相同物质的量的SO2和SO3 , 下列说法中正确的是( )
A.硫元素的质量比为5:4
B.任何情况下体积比均为1:1
C.含有的O2、O3两分子数之比为1:1
D.SO2、SO3两分子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是细胞中3种化合物含量的扇形图,图2是活细胞中元素含量的柱形图,下列说法中不正确的是( )
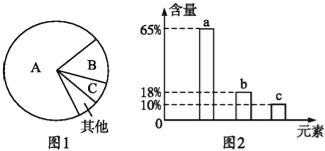
A. 图1中A、B、C分别是水、蛋白质、脂质;图2中a、b、c三种元素依次表示碳、氢、氧
B. 若图1表示正常细胞,则B化合物具有多样性,其必含图2中的a、b、c
C. 若图1表示正常细胞,则A中不含图2中的b
D. 图1可以表示人体细胞完全脱水后化合物含量的扇形图,而此时含量最多的元素为图2中的b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子, X、Y、Z、P分别为构成生物大分子的基本单位,请回答下列问题:
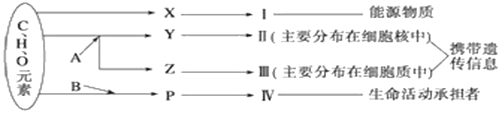
(1)Ⅰ在小麦种子中主要是指______,其基本单位X是______。
(2)A代表的元素是____,Ⅱ是____,Ⅲ是RNA,Z是_____。
(3)Ⅳ一定含有的元素有______。P的结构通式是______,图中由P形成Ⅳ的反应方式称为____,Ⅳ的特定功能的发挥与其_____结构有关。若P的平均相对分子质量r,由多个P形成m条肽链,经盘曲折叠形成了相对分子质量为e的Ⅳ,则Ⅳ分子中肽键的数目是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
(一)实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:____________、_____________。
(2)取10.00 mL待测液,选择右图中_________(填A或B)来移取。

(3)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________,直到滴定终点。滴定达到终点的标志是:_________。
(4)根据下列数据,烧碱的纯度为:_______________________(纯度=纯物质的质量/样品的质量×100%)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(二)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)计算:血液中含钙离子的浓度为_____mol·L-1。
【答案】 胶头滴管 100mL容量瓶 A 锥形瓶内颜色的变化 最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 酸式 2.5×10-3
【解析】(一)(1)配制一定浓度的溶液,需要用到100mL的容量瓶,还需要胶头滴管定容。
(2)待测的氢氧化钠溶液应该使用碱式滴定管,选择A。
(3)滴定时眼睛应该注意锥形瓶内液体颜色的变化,达到终点时要及时停止滴定。滴定终点的现象为:溶液红色褪去且30s不复原,所以答案为:最后一滴盐酸滴进锥形瓶内红色褪去且30s不复原。
(4)两次滴定加入的盐酸的体积分别为19.90mL和20.10mL,所以平均为20.00mL,所以HCl的物质的量为20×0.5÷1000=0.01mol,所以氢氧化钠为0.01mol,因为配了100mL溶液取出10mL进行的滴定,所以原来的氢氧化钠为0.1mol,质量为4g,质量分数为4÷5=80%。
(二)(1)KMnO4滴定H2C2O4的方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O,对应的离子方程式为:2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2
(2)高锰酸钾具有强氧化性,会氧化碱式滴定管下端的橡胶管,所以只能用酸式滴定管盛放。
(3)根据反应的整个过程,得到如下的关系式Ca2+~CaC2O4~H2C2O4~2/5 KMnO4,所以Ca2+是KMnO4的5/2倍。高锰酸钾为20×1×10-4÷1000=2×10-6mol,所以Ca2+为5×10-6mol,所以浓度为5×10-6÷0.002=2.5×10-3mol/L。
【题型】实验题
【结束】
20
【题目】盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol· L-1;
H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1。
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因________________。
②常温下,物质的量浓度相同的下列四种溶液:a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、碳酸氢钠溶液。其pH由大到小的顺序是:___________(填序号)。
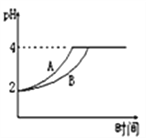
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如下图所示。则表示醋酸溶液pH变化的曲线是___ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。则 m1 ___ m2 ( 选填“<”、“=”、“>”)。
(3)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图如下,其中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是_______;该醋酸溶液稀释过程中,下列各量一定变小的是______________。
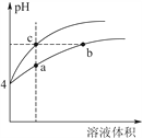
a.c(H+) b.c(OH-)
c. ![]() d.
d. 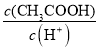
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com