
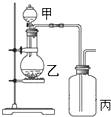
 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NH3 | 浓氨水 | CaO | H2O |
| B | 制取并验证C2H2可被KMnO4酸性溶液氧化 | 饱和食盐水 | 电石 | KMnO4酸性溶液 |
| C | 制取并验证Cl2没有漂白性 | 浓盐酸 | MnO2 | 干燥的红布条 |
| D | 制取并验证SO2具有漂白性 | 70%硫酸 | Na2SO3 | 品红试液 |
| A、A | B、B | C、C | D、D |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g) Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
| 400℃ |
 下列有关说法正确的是( )
下列有关说法正确的是( )| A、三聚氯氰中C1的化合价是+1 |
| B、该反应中NaCN被还原 |
| C、三聚氯氰分子中既含σ键又含π健 |
| D、36.9 g三聚氯氰中含有1.204×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 选项 | 发生装置中的药品 | 干燥和集气装置 |
| A | 亚硫酸钠和稀盐酸 | 图2 |
| B | 大理石和稀盐酸 | 图1 |
| C | 铜和稀硝酸 | 图2 |
| D | 氧化钙和浓氨水 | 图1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
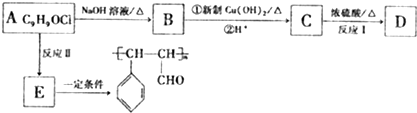
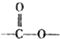 结构的芳香族化介物的同分异构体有
结构的芳香族化介物的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中至少有2种阳离子 |
| B、只能确定溶液中NH4+、SO42-是否存在 |
| C、溶液中最多有4种阴离子 |
| D、溶液中不可能同时存在K+和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去NO中混有的NO2将混合气体先通过足量水,然后用CaCl2干燥 |
| B、配制一定物质的量浓度的Fe(NO3)2溶液:将一定量的Fe(NO3)2溶于适量的硝酸中,再加入水稀释至指定浓度 |
| C、向足量饱和石灰水中加入少CaO,恢复至室温后溶液pH变大 |
| D、工业上分別用电解熔融Al2O3、MgO、NaCl的方法制取Al、Mg、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
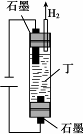 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
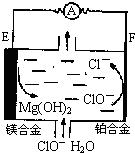 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com