

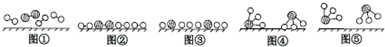
 、
、 、
、 分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂
分别表示N2、H2、NH3图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别 是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂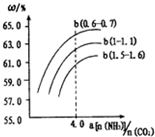
分析 氮气、氢气在合成塔中合成氨气,氨气在氧化炉中氧化为NO,NO、氧气、水吸收塔中合成硝酸,硝酸与氨气合成硝酸铵.
(1)B中发生氨气的催化氧化生成NO,设备为氧化炉;
(2)在上述工业生产中,N2与H2合成NH3的傕化剂是铁砂网;
氮气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,在催化剂表面N2、H2中的化学键断裂;图④在催化剂形成NH3;图⑤脱离催化剂表面;
(3)①氨碳比一定时,选择二氧化碳转化率最大时的碳水比;
②氨碳比a大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本,氨碳比a小于4.0时,二氧化碳的转化率较小;
(4)合成氨为放热反应,温度太高不利于氨气生成,并进行原料气的预热,充分利用余热,节约能源;
在合成硝酸的吸收塔中通入空气,使NO循环利用,全部转化为硝酸;
(5)根据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(6)假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,根据原子守恒计算制备硝酸的氨气,每一步损失率、利用率都以氨气计算.
解答 解:(1)氨气在氧化炉中被催化氧化,B设备的名称是氧化炉;氨气被氧化为NO和水,其反应的方程式为:4NH3+5O2 $\frac{\underline{\;Rt-Rh\;}}{△}$4NO+6H2O;
故答案为:氧化炉;4NH3+5O2 $\frac{\underline{\;Rt-Rh\;}}{△}$4NO+6H2O;
(2)N2与H2合成NH3所用的催化剂是铁砂网;氮气、氢气在催化剂表面合成氨反应过程的顺序为:图①氮气分子和氢气分子向催化剂表面靠近,图②氮气和氢气吸附在催化剂的表面,图③在催化剂的作用下分解成氢原子和氮原子,在催化剂表面N2、H2中的化学键断裂;图④在催化剂形成NH3;图⑤脱离催化剂表面;
故答案为:铁砂网;N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂;
(3)①氨碳比a($\frac{n(N{H}_{3})}{n(C{O}_{2})}$)相同时,水碳比($\frac{n({H}_{2}O)}{n(C{O}_{2})}$)为0.6~0.7时,二氧化碳转化率最大,
故答案为:c;
②氨碳比a($\frac{n(N{H}_{3})}{n(C{O}_{2})}$)大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a($\frac{n(N{H}_{3})}{n(C{O}_{2})}$)小于4.0时,二氧化碳的转化率较小,
故答案为:氨碳比a($\frac{n(N{H}_{3})}{n(C{O}_{2})}$)大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a($\frac{n(N{H}_{3})}{n(C{O}_{2})}$)小于4.0时,二氧化碳的转化率较小;
(4)合成氨的反应属于放热反应,反应过程中会放出大量的热,用热交换器并进行原料气的预热,可以充分利用余热,节约能源,还有利于氨气的生成;在吸收塔中二氧化氮与水反应生成硝酸和NO,通入空气,NO能被空气中的氧气氧化为二氧化氮,二氧化氮再与水反应生成硝酸,这样使NO循环利用,全部转化为硝酸;
故答案为:利用余热,节约能源;使NO循环利用,全部转化为硝酸;
(4)碱液吸收法:NO+NO2+2NaOH═2NaNO2+H2O,NH3还原法:8NH3+6NO2 $\frac{\underline{催化剂}}{△}$7N2+12H2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法;
故答案为:氨气还原法;
(5)假设硝酸铵的物质的量为1mol,则与硝酸反应的氨气为1mol,制备的硝酸为1mol,令制备硝酸的氨气为xmol,每一步损失率、利用率都以氨气计算,根据原子守恒,xmol×96%×92%=1mol,解得x=$\frac{10000}{96×92}$%,故制HNO3所用去的氨气的质量占总耗氨的质量分数是$\frac{\frac{10000}{96×92}mol}{1mol+\frac{10000}{96×92}mol}$×100%≈53.1%,
故答案为:53.1%.
点评 本题考查化学工业制备、阅读获取信息的能力、化学计算等,(6)中注意利用守恒思想计算,也可以利用关系式计算,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.9 | 8.9 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | X、W分别形成的氢化物中所含化学键种类相同 | |
| D. | Z、W形成化合物的电子式为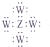 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性:N<O<F | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 热稳定性:HF>HCl>H2S | D. | 原子半径:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com